19-20高一·浙江·阶段练习
1 . 双氧水和84消毒液是生活中常用的两种消毒剂。了解物质的性质是科学合理使用化学品的基础和前提,请回答下列问题:
(1)某同学设计如下实验研究H2O2的性质:
①从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是_____________ 。
②能证明H2O2具有还原性的实验是______ (填序号)。可作为证据的实验现象是____ (填字母序号)。
(2)84消毒液的有效成分为NaClO。
①将Cl2通入NaOH溶液中可制得84消毒液,化学反应方程式为___________ 。
②84消毒液不能用于钢制器具的消毒,原因是NaClO具有_____________ 。
③84消毒液的溶液在浸泡餐具过程中,因吸收空气中CO2消毒杀菌能力增强,原因是__________ 。
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长。池水变绿。一种可能的原因是 NaClO与H2O2反应产生O2促进藻类快速生长。
①该反应说明氧化性:NaClO____ H2O2的(填 “>”或“<" )。
②当有0.1 mol O2生成时,转移电子__________ mol.。
(1)某同学设计如下实验研究H2O2的性质:
| 序号 | 实验 | 实验现象 |
| i | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(2)84消毒液的有效成分为NaClO。
①将Cl2通入NaOH溶液中可制得84消毒液,化学反应方程式为
②84消毒液不能用于钢制器具的消毒,原因是NaClO具有
③84消毒液的溶液在浸泡餐具过程中,因吸收空气中CO2消毒杀菌能力增强,原因是
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长。池水变绿。一种可能的原因是 NaClO与H2O2反应产生O2促进藻类快速生长。
①该反应说明氧化性:NaClO
②当有0.1 mol O2生成时,转移电子
您最近一年使用:0次
名校
2 . 纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:_____ 。
(2)实验室中用过氧化氢制取氧气的化学方程式为____ ,当生成标准状况下1.12 L O2时,转移电子为___ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:___________ 。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式____________ 。
②滴定到达终点的现象是____________ 。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为____ mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____ (填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确___________ 。
(1)写出过氧化氢的电子式:
(2)实验室中用过氧化氢制取氧气的化学方程式为
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式
②滴定到达终点的现象是
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确
您最近一年使用:0次
名校
解题方法
3 . 设 为阿伏加 德罗常数的值。由一种金属阳离子(或
为阿伏加 德罗常数的值。由一种金属阳离子(或 )与两种酸根阴离子组成的盐称为混盐。向混盐
)与两种酸根阴离子组成的盐称为混盐。向混盐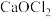 中加入浓硫酸,发生反应:
中加入浓硫酸,发生反应: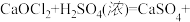
 。下列说法正确的是( )
。下列说法正确的是( )
 为阿伏加 德罗常数的值。由一种金属阳离子(或
为阿伏加 德罗常数的值。由一种金属阳离子(或 )与两种酸根阴离子组成的盐称为混盐。向混盐
)与两种酸根阴离子组成的盐称为混盐。向混盐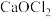 中加入浓硫酸,发生反应:
中加入浓硫酸,发生反应: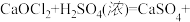
 。下列说法正确的是( )
。下列说法正确的是( )| A.明矾、小苏打都是混盐 |
| B.在题述反应中,浓硫酸体现氧化性和酸性 |
C.每产生1mol ,转移的电子数为 ,转移的电子数为 |
D.1mol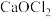 中所含离子数为4 中所含离子数为4 |
您最近一年使用:0次
2020-10-07更新
|
256次组卷
|
14卷引用:【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题
【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题2020届高三《新题速递·化学》12月第01期(考点01-06)2020届高三化学化学二轮复习——高考常考题:氧化还原反应的相关计算【精编24题】湖南省长沙市长郡中学2020届高三月考(六)理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(一)江苏省徐州市第一中学2019-2020学年高二下学期第四次线上周考化学试题安徽省六安市舒城中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高一必修第一册第二章 海水中的重要元素 高考挑战区辽宁省六校协作体2020-2021学年高二上学期期初考试化学试题高一必修第一册(苏教2019版)专题3 C 高考挑战区 过模拟 2年模拟精编精练甘肃省天水市甘谷县第四中学2021届高三上学期第二次检测化学试题江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期第五次月考化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一下学期期中考试化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
4 . 氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气。
I.工业上通常采用电解法制氯气:观察图1,回答:


(1)电解反应的化学方程式为__________ 。
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是___________ 。
Ⅱ.某兴趣小组设计如图2所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(3)B中反应的化学方程式是_________ 。
(4)该兴趣小组用100mL12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____ g。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在装置B中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施_______ 。
②试判断另一个副反应(用化学方程式表示)_________ ,为避免此副反应的发生,可将装置做何改进_________ 。
I.工业上通常采用电解法制氯气:观察图1,回答:


(1)电解反应的化学方程式为
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是
Ⅱ.某兴趣小组设计如图2所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(3)B中反应的化学方程式是
(4)该兴趣小组用100mL12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在装置B中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施
②试判断另一个副反应(用化学方程式表示)
您最近一年使用:0次
5 . 下列与Cl2有关的说法正确的是
| A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂 |
| B.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C.0.1 mol Cl2与足量NaOH溶液反应,转移0.2 mol电子 |
| D.氯气作水的杀菌消毒剂时没有发生化学变化 |
您最近一年使用:0次
解题方法
6 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO ·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
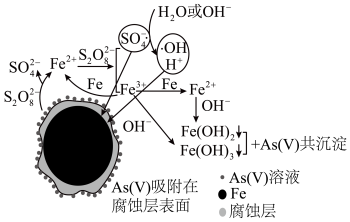
 ·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
·、·OH表示自由基)。设阿伏加 德罗常数的值为NA。下列叙述错误的是()
| A.过硫酸钠中-2价氧与-1价氧的个数比为3:1 |
| B.若56gFe参加反应,共有1.5NA个S2O82−被还原 |
| C.碱性条件下硫酸根自由基发生反应的方程式为SO4-·+OH-=SO42-+·OH |
| D.pH越小,越有利于去除废水中的正五价砷 |
您最近一年使用:0次
名校
解题方法
7 . H2O2作为一种绿色消毒剂,在公共卫生事业中发挥了重要的作用。回答问题:
(1)H2O2中氧元素的化合价为________ 价。
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是______ 。
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2_____ L,转移电子______ mol。
(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是_________ 。
(1)H2O2中氧元素的化合价为
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2
 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素的最高价氧化物的水化物是酸性最强的含氧酸。回答下列问题:
(1)元素X的离子结构示意图为_______________ 。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是_______________ 。
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子式_________ ,与该离子电子总数相等的Z与氢元素形成的微粒是_____________ 。(写一种即可)
(4) ZW3常温下呈液态,可与水反应生成一种酸和一种碱,写出生成对应的酸和碱的化学方程式为_______________ 。
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___________ (用酸的分子式表示)。
Ⅱ.下表为元素周期表的一部分。
回答下列问题:
(1)Z元素在周期表中的位置为____ 。
(2)表中元素原子半径最小的是_____ (写元素符号)。
(3)下列事实不能说明Y元素的非金属性比S元素的非金属性强的是_____ 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,l mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.8 mol.L-1 NaOH溶液和1.2 molO2,则两种气体的分子式及物质的量分别为_______________ 、_______________ ,生成硫酸铜物质的量为______ 。
(1)元素X的离子结构示意图为
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子式
(4) ZW3常温下呈液态,可与水反应生成一种酸和一种碱,写出生成对应的酸和碱的化学方程式为
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
Ⅱ.下表为元素周期表的一部分。
| 碳 | 氮 | Y | |
| X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为
(2)表中元素原子半径最小的是
(3)下列事实不能说明Y元素的非金属性比S元素的非金属性强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,l mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.8 mol.L-1 NaOH溶液和1.2 molO2,则两种气体的分子式及物质的量分别为
您最近一年使用:0次
9 . 氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________ ;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________ 。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______ ,转移电子数为_________ 。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________ 。
Ⅰ.实验室制备氯气的化学方程式是
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式
您最近一年使用:0次
10 . 下列有关说法正确的是

A. g铁与足量 g铁与足量 充分反应,转移电子数为 充分反应,转移电子数为 |
B.由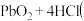 浓 浓 可确定氧化性: 可确定氧化性: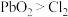 |
C. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的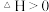 |
D.常温下,用蒸馏水不断稀释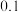 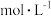 醋酸,溶液中 醋酸,溶液中 的值减小 的值减小 |
您最近一年使用:0次



