1 . 抗击新冠病毒期间,各地大规模进行环境消毒,其中“84”消毒液试用比较广泛。如图是某“84”消毒液的标签,该“84”消毒液的物质的量浓度为_____  ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为_____  ?
?
 ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为 ?
?| “84”消毒液 [有效成分]NaClO [规格]1000mL [质量分数]37.25% [密度] 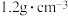 |
您最近一年使用:0次
2 . 实验室欲用98%的浓硫酸(密度为1.84 g·cm-3)配制1.5 mol·L-1的稀硫酸90 mL。
(1)仪器的选择:配制溶液时,下列仪器不需要用到的是___________ (填字母)。
A.天平 B.100 mL容量瓶 C.玻璃棒
D.烧杯 E.量筒 F.250 mL容量瓶
还需要补充的仪器是___________ 。
(2)通过计算,用量筒量取浓硫酸的体积为___________ mL。
(3)稀释浓硫酸,冷却后移液,再进行定容、摇匀等一系列操作。从配制好的溶液中取出10 mL,加水稀释至100 mL,稀释后硫酸的物质的量浓度为___________ mol·L-1。
(1)仪器的选择:配制溶液时,下列仪器不需要用到的是
A.天平 B.100 mL容量瓶 C.玻璃棒
D.烧杯 E.量筒 F.250 mL容量瓶
还需要补充的仪器是
(2)通过计算,用量筒量取浓硫酸的体积为
(3)稀释浓硫酸,冷却后移液,再进行定容、摇匀等一系列操作。从配制好的溶液中取出10 mL,加水稀释至100 mL,稀释后硫酸的物质的量浓度为
您最近一年使用:0次
3 . 下列有关物质的量浓度的计算结果错误的是
A.实验室双氧水的质量分数为27.5%(密度为1.10 ),其浓度为8.9 ),其浓度为8.9 |
B.一定质量的28%的KOH溶液,若将其蒸发掉100g水后(无固体析出),溶液的质量分数为56%,溶液的体积变为125mL,则浓缩后溶液中KOH的物质的量浓为8 |
C.在KCl、 、 、 和 和 的混合溶液,若 的混合溶液,若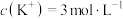 、 、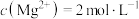 、 、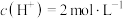 、 、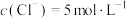 ,则溶液中 ,则溶液中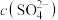 是2 是2 |
D.将8g铁粉放入100mL  溶液中,溶液中的 溶液中,溶液中的 全部被还原时,过滤后固体质量变为8.2g,则原溶液 全部被还原时,过滤后固体质量变为8.2g,则原溶液 的为2.5 的为2.5 |
您最近一年使用:0次
名校
4 . 100g 12mol/L(密度为1.19g/mL)的盐酸用100g水稀释后,其物质的量浓度_______ (填“大于”、“等于”或“小于”)6mol/L。
您最近一年使用:0次
名校
5 . 化学计量在化学知识体系中占有重要地位,请回答下列问题。
(1)标准状况下,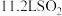 的物质的量是
的物质的量是___________ ,质量是___________ g。
(2)同温同压下,质量相等的 、
、 、
、 、
、 四种气体中,含有分子数目最多的是
四种气体中,含有分子数目最多的是___________ ,密度最大的是___________ 。
(3) 中含有的
中含有的 为
为 ,则X的摩尔质量为
,则X的摩尔质量为___________ 。
(4) 的盐酸与
的盐酸与 铁屑反应,参与反应的
铁屑反应,参与反应的 物质的量为
物质的量为___________ ,生成的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(5)现有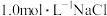 溶液
溶液 ,若取
,若取 该溶液用水稀释到
该溶液用水稀释到 ,所得溶液的
,所得溶液的 的物质的量浓度为
的物质的量浓度为___________ 。
(1)标准状况下,
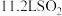 的物质的量是
的物质的量是(2)同温同压下,质量相等的
 、
、 、
、 、
、 四种气体中,含有分子数目最多的是
四种气体中,含有分子数目最多的是(3)
 中含有的
中含有的 为
为 ,则X的摩尔质量为
,则X的摩尔质量为(4)
 的盐酸与
的盐酸与 铁屑反应,参与反应的
铁屑反应,参与反应的 物质的量为
物质的量为 在标准状况下的体积为
在标准状况下的体积为(5)现有
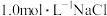 溶液
溶液 ,若取
,若取 该溶液用水稀释到
该溶液用水稀释到 ,所得溶液的
,所得溶液的 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
解题方法
6 . 《黄帝九鼎神丹经诀》卷九中记载着“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼等工业中。请根据要求回答下列问题:
(1)纯净的液态硫酸______ (填“能”或“几乎不能”)导电,在硫酸不断稀释的过程中,溶液导电能力的变化情况为______ 。
(2)硫酸是强酸,具有酸的通性,如稀硫酸与氧化铁反应的化学方程式为______ ,但浓硫酸与氧化亚铁反应的化学方程式为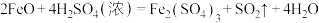 ,该反应属于
,该反应属于______ (填“氧化还原反应”或“非氧化还原反应”)。
(3)某浓硫酸的说明如图所示。该浓硫酸的物质的量浓度为______  ,从中取出100mL,则该100mL浓硫酸的物质的量浓度为
,从中取出100mL,则该100mL浓硫酸的物质的量浓度为______  ,含
,含 的物质的量为
的物质的量为______ mol。
(4)如果取5mL该浓硫酸,加水稀释至10mL,那么稀释后的硫酸的质量分数______ (填“大于”、“小于”或“等于”,下同)49%;如果取5mL该浓硫酸,加等质量的水稀释,那么稀释后的硫酸的物质的量浓度______ 原浓硫酸的物质的量浓度的一半。
(1)纯净的液态硫酸
(2)硫酸是强酸,具有酸的通性,如稀硫酸与氧化铁反应的化学方程式为
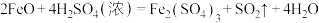 ,该反应属于
,该反应属于(3)某浓硫酸的说明如图所示。该浓硫酸的物质的量浓度为
 ,从中取出100mL,则该100mL浓硫酸的物质的量浓度为
,从中取出100mL,则该100mL浓硫酸的物质的量浓度为 ,含
,含 的物质的量为
的物质的量为| 硫酸 化学纯 CP 500mL 品名:硫酸 化学式:  相对分子质量:98 密度:1.84  质量分数:98% |
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
|
7 . 用胆矾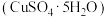 配制
配制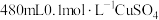 溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平、胶头滴管等。
溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平、胶头滴管等。
(1)下列有关容量瓶的使用方法的操作中,错误的是_______(填序号)。
(2)配制时,还缺少的玻璃仪器是_______ 。该实验中两次用到玻璃棒,其作用分别是搅拌和_______ 。
(3)配制该溶液时,可以选择用托盘天平称取固体 的质量为
的质量为_______ g。
(4)定容时的操作:当液面接近容量瓶刻度线 时,改用胶头滴管滴加蒸馏水至
时,改用胶头滴管滴加蒸馏水至_______ ,再将容量瓶塞盖好,反复上下颠倒摇匀。
(5)配制过程中,下列操作使所配溶液的浓度偏大的有_______(填序号)。
(6)从配制好的 溶液中取出
溶液中取出 ,加蒸馏水将其稀释至
,加蒸馏水将其稀释至 ,稀释后
,稀释后 溶液的浓度为
溶液的浓度为_______  。
。
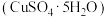 配制
配制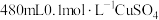 溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平、胶头滴管等。
溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平、胶头滴管等。(1)下列有关容量瓶的使用方法的操作中,错误的是_______(填序号)。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 |
| C.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁 |
| D.容量瓶是细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞 |
(3)配制该溶液时,可以选择用托盘天平称取固体
 的质量为
的质量为(4)定容时的操作:当液面接近容量瓶刻度线
 时,改用胶头滴管滴加蒸馏水至
时,改用胶头滴管滴加蒸馏水至(5)配制过程中,下列操作使所配溶液的浓度偏大的有_______(填序号)。
| A.用“左码右物”的称量方法称量晶体 |
| B.移液后,未洗涤烧杯和玻璃棒 |
| C.胆矾晶体部分失去结晶水 |
| D.定容时,俯视刻度线 |
 溶液中取出
溶液中取出 ,加蒸馏水将其稀释至
,加蒸馏水将其稀释至 ,稀释后
,稀释后 溶液的浓度为
溶液的浓度为 。
。
您最近一年使用:0次
2023高三·全国·专题练习
8 . 现有浓H3PO4质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的H3PO4溶液,则需浓H3PO4_______ mL(保留一位小数)。
您最近一年使用:0次
名校
9 . 填空。
(1)工业上用_______ 和_______ 作为原料来制取漂白粉,反应的化学方程式为_______ 。漂白粉的有效成分是_______ ,漂白粉溶于水后,滴加少量盐酸可加快漂白和杀菌的速度,此过程中发生反应的化学方程式_______ 。
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是_______ 。将取出的溶液稀释至100 mL,其Na+的物质的量浓度是_______ 。
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L, 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为_______ 。
(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有_______ 个CO分子,该混合气体中CO与CO2的密度之比为_______ 。
(1)工业上用
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L,
 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有
您最近一年使用:0次
名校
10 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时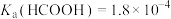
(1)配制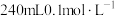 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液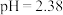 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: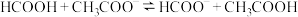 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数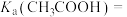
_______ 。
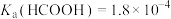
(1)配制
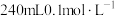 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
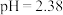 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
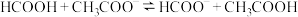 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数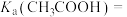
您最近一年使用:0次
2022-11-12更新
|
230次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题



