名校
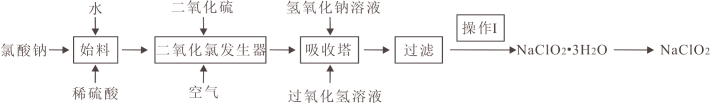
1 . 过氧化氢法生产亚氯酸钠(NaClO2)工艺流程如图,下列说法正确的是

| 温度℃ | 10 | 20 | 30 | 40 | 50 | |
| 溶解度 | NaOH | 51 | 109 | 119 | 129 | 145 |
| NaClO2 | 37 | 40.5 | 46 | 50.7 | 53.7 | |
| A.升高温度,反应速率加快,要提高产量吸收塔内应该维持较高温度 |
| B.吸收塔内发生反应的化学方程式为2ClO2+H2O2+2NaOH=2NaClO2+H2O+O2 |
| C.操作I为洗涤除杂 |
| D.为了使ClO2充分反应,应保持氢氧化钠溶液在吸收塔内稍过量 |
您最近一年使用:0次
2021-07-04更新
|
96次组卷
|
2卷引用:河南省2020-2021学年高二下学期领军考试7月联考化学试题
解题方法
2 . 写出下列化学反应的方程式
(1)加热时,三氧化二锰与一氧化碳反应产生四氧化三锰________ 。
(2)将KCN加入到过量的CuSO4水溶液中_________ 。
(3)在碱性溶液中,Cr2O3和K3Fe(CN)6反应_______ 。
(4)在碱性条件下,Zn(CN)42-和甲醛反应_______ 。
(5)Fe(OH)2在常温无氧条件下转化为Fe3O4_________ 。
(6)将NaNO3粉末小心加到熔融的NaNH2中,生成NaN3(没有水生成)_______ 。
(1)加热时,三氧化二锰与一氧化碳反应产生四氧化三锰
(2)将KCN加入到过量的CuSO4水溶液中
(3)在碱性溶液中,Cr2O3和K3Fe(CN)6反应
(4)在碱性条件下,Zn(CN)42-和甲醛反应
(5)Fe(OH)2在常温无氧条件下转化为Fe3O4
(6)将NaNO3粉末小心加到熔融的NaNH2中,生成NaN3(没有水生成)
您最近一年使用:0次
3 . 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOX还原成N2,某同学在实验室中,对NH3与NO2反应进行了探究,回答下列问题:
(1)写出NH3和NO2生成N2的化学方程式_______ ,该反应中氧化剂和还原剂的物质的量之比_______ 。生成1molN2转移的电子数为_______ NA.被氧化的物质物质的量为_______ mol
(2)某同学认为铜和浓硝酸在常温下可制得NO2,由此可推测出铁和浓硝酸在常温下也能制得NO2,他的推测正确吗?_______ (“正确”或“不正确”),请说明原因_______ 。
(1)写出NH3和NO2生成N2的化学方程式
(2)某同学认为铜和浓硝酸在常温下可制得NO2,由此可推测出铁和浓硝酸在常温下也能制得NO2,他的推测正确吗?
您最近一年使用:0次
名校
解题方法
4 . 在反应5SO2+2 +2H2O=2Mn2++4H++5
+2H2O=2Mn2++4H++5 中,还原剂为
中,还原剂为
 +2H2O=2Mn2++4H++5
+2H2O=2Mn2++4H++5 中,还原剂为
中,还原剂为| A.SO2 | B. | C.Mn2+ | D. |
您最近一年使用:0次
2021-06-13更新
|
1000次组卷
|
8卷引用:浙江省温州市2020-2021学年高一下学期期末教学质量统一监测(学考模拟)化学试题
浙江省温州市2020-2021学年高一下学期期末教学质量统一监测(学考模拟)化学试题(已下线)1.3.2 氧化剂和还原剂-2021-2022学年高一化学10分钟课前预习练(人教版2019必修第一册)(附参考答案)(已下线)2022年1月浙江省普通高中学业水平考试化学仿真模拟试卷A广东省惠州市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)吉林省白城市通榆县毓才高级中学2022-2023学年高一上学期第一次月考化学试题湖南省耒阳市东江中学2020-2021学年高一下学期期末考试化学试题(已下线)专题七 氧化还原反应
20-21高三下·浙江·阶段练习
5 . 已知A是空气中含量最高的一种气体,D是种重要的无机化工原料,由A到D的转化过程如图所示(如图: 表示物质,
表示物质, 表示过程,反应条件及催化剂未标出)。
表示过程,反应条件及催化剂未标出)。
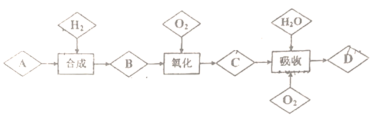
回答下列问题:
(1)物质A的电子式为___________ ,物质D的分子式为___________ 。
(2)“合成"需要在高温、高压和催化剂的条件下进行,其发生反应的化学方程式___________ 。
(3)“吸收”中通入过量O2的目的是___________ 。
(4)工业上贮存物质D的溶液可选择的罐体材料为___________ (填标号)。
a.银 b.铜 c.铝 d.锌
 表示物质,
表示物质, 表示过程,反应条件及催化剂未标出)。
表示过程,反应条件及催化剂未标出)。
回答下列问题:
(1)物质A的电子式为
(2)“合成"需要在高温、高压和催化剂的条件下进行,其发生反应的化学方程式
(3)“吸收”中通入过量O2的目的是
(4)工业上贮存物质D的溶液可选择的罐体材料为
a.银 b.铜 c.铝 d.锌
您最近一年使用:0次
20-21高一下·江苏南通·阶段练习
解题方法
6 . 大苏打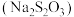 常用于防毒面具中吸收氯气,1molNa2S2O3完全反应,失去8mol电子,下列说法正确的是
常用于防毒面具中吸收氯气,1molNa2S2O3完全反应,失去8mol电子,下列说法正确的是
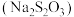 常用于防毒面具中吸收氯气,1molNa2S2O3完全反应,失去8mol电子,下列说法正确的是
常用于防毒面具中吸收氯气,1molNa2S2O3完全反应,失去8mol电子,下列说法正确的是| A.氧化性:Na2S2O3>Cl2 |
B.反应中 转化为 转化为 |
C.氧化产物与还原产物的物质的量之比为 |
| D.标准状况下,每吸收8.4LCl2,反应中转移0.75mol电子 |
您最近一年使用:0次
名校
7 . (1)漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如下。
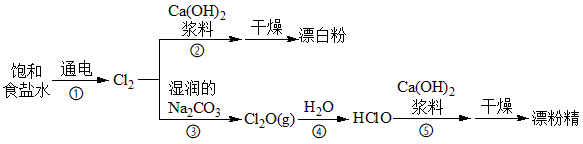
回答下列问题:
Ⅰ.写出①中阳极的电极反应式为___________ 。
Ⅱ.上述过程涉及反应主要有___________ 。
A.氧化还原反应 B.化合反应 C.复分解反应 D.分解反应
(2)NaClO2的漂白能力是漂白粉的4~5倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
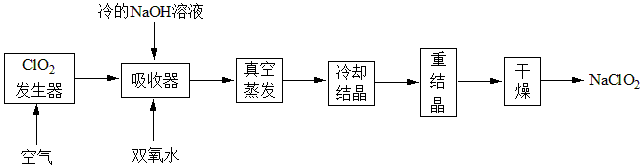
已知:ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4 = 2ClO2+2NaHSO4。
Ⅰ.反应结束后,向ClO2发生器中通入一定量空气的目的:___________ 。
Ⅱ.吸收器中生成NaClO2的离子反应方程式为___________ 。

回答下列问题:
Ⅰ.写出①中阳极的电极反应式为
Ⅱ.上述过程涉及反应主要有
A.氧化还原反应 B.化合反应 C.复分解反应 D.分解反应
(2)NaClO2的漂白能力是漂白粉的4~5倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

已知:ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4 = 2ClO2+2NaHSO4。
Ⅰ.反应结束后,向ClO2发生器中通入一定量空气的目的:
Ⅱ.吸收器中生成NaClO2的离子反应方程式为
您最近一年使用:0次
8 . 某废水理氨废水,反应为NH3+2O2
 +H++H2O,6H++6
+H++H2O,6H++6 +5CH3OH
+5CH3OH 3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为
3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为 的转化率可达95%,而
的转化率可达95%,而 转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为
转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为

 +H++H2O,6H++6
+H++H2O,6H++6 +5CH3OH
+5CH3OH 3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为
3N2↑+5CO2↑+13H2O。在处理过程中,NH3转化为 的转化率可达95%,而
的转化率可达95%,而 转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为
转化为N2的转化率可达96%。若每天处理含NH30.034 g·L-1的废水500 m3,则理论上每天所需甲醇的质量为| A.24.32 kg | B.30 kg | C.25.3 kg | D.4.08 kg |
您最近一年使用:0次
2021-06-01更新
|
59次组卷
|
2卷引用:云南省元江县一中2020-2021学年高一上学期期中考试化学试题
9 . 皮蛋,又称松花蛋,因其独特的口味,是不少市民心爱的食物。传统皮蛋的主要原料有生石灰、纯碱、食盐、红茶、植物灰等。央视曝光了某皮蛋生产企业使用工业硫酸铜“炮制”皮蛋,工业硫酸铜中含有大量重金属。

硫酸铜是重要的工业原料。对下列有关硫酸铜的制备方法进行讨论。
查阅资料可知:铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应。
(1)工业上是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取CuSO4溶液的。写出铜屑在此状态下发生的一系列反应的化学方程式:___________ 。
(2)利用铜和浓硫酸在加热条件下反应也能制备CuSO4溶液,在该反应中硫酸表现出___________ ,氧化剂与还原剂的物质的量之比是___________ 。写出反应的化学方程式:___________ 。
(3)试分析以上两种方法哪种好,说明原因:___________ 。

硫酸铜是重要的工业原料。对下列有关硫酸铜的制备方法进行讨论。
查阅资料可知:铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应。
(1)工业上是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取CuSO4溶液的。写出铜屑在此状态下发生的一系列反应的化学方程式:
(2)利用铜和浓硫酸在加热条件下反应也能制备CuSO4溶液,在该反应中硫酸表现出
(3)试分析以上两种方法哪种好,说明原因:
您最近一年使用:0次
名校
解题方法
10 . 用FeCl3、CuCl2的混合溶液作吸收剂可吸收工厂排放的含H2S的废气,从而减少空气污染并回收S,其过程如图所示(各步均进行完全)。下列叙述正确的是
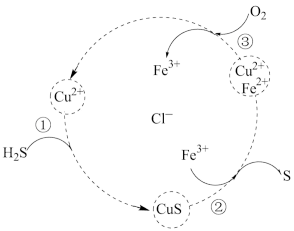

| A.①反应的离子方程式为: S2-+Cu2+= CuS |
| B.在转化过程中化合价没有变化的元素只有H |
| C.回收32gS时,理论上需要消耗标准状况O211.2 L |
| D.吸收剂吸收前后混合溶液中Fe3+、Cu2+浓度不变 |
您最近一年使用:0次
2021-05-31更新
|
1110次组卷
|
5卷引用:四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题



