2021高三·全国·专题练习
1 . 已知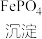
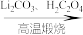 LiFePO4,写出该反应的化学方程式
LiFePO4,写出该反应的化学方程式___ 。
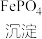
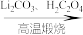 LiFePO4,写出该反应的化学方程式
LiFePO4,写出该反应的化学方程式
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
2 . 氯苯( )是重要的化工原料,某同学通过查阅资料后设计了如图所示的装置制备粗氯苯。(夹持装置及加热装置已省略)
)是重要的化工原料,某同学通过查阅资料后设计了如图所示的装置制备粗氯苯。(夹持装置及加热装置已省略)
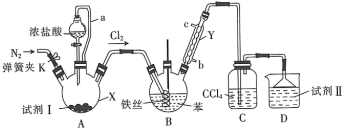
若试剂Ⅰ为紫黑色固体,写出装置A中发生反应的离子方程式:___________ 。
 )是重要的化工原料,某同学通过查阅资料后设计了如图所示的装置制备粗氯苯。(夹持装置及加热装置已省略)
)是重要的化工原料,某同学通过查阅资料后设计了如图所示的装置制备粗氯苯。(夹持装置及加热装置已省略)
若试剂Ⅰ为紫黑色固体,写出装置A中发生反应的离子方程式:
您最近一年使用:0次
2021高三·全国·专题练习
3 . 草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿粉(主要成分为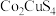 ,还含一定量
,还含一定量 )为原料,生产草酸钴晶体(
)为原料,生产草酸钴晶体( )的工艺流程如下:
)的工艺流程如下:
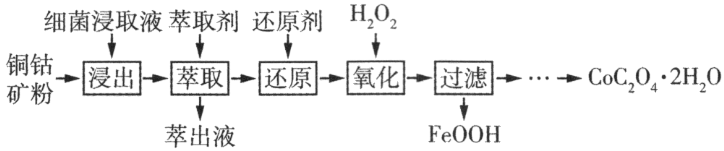
已知:①“浸出”液含有的离子主要有 、
、 、
、 、
、 、
、 ;
;
②草酸钴晶体难溶于水。
回答下列问题:
“氧化”过程中发生的主要反应的离子方程式为___________ 。
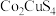 ,还含一定量
,还含一定量 )为原料,生产草酸钴晶体(
)为原料,生产草酸钴晶体( )的工艺流程如下:
)的工艺流程如下:
已知:①“浸出”液含有的离子主要有
 、
、 、
、 、
、 、
、 ;
;②草酸钴晶体难溶于水。
回答下列问题:
“氧化”过程中发生的主要反应的离子方程式为
您最近一年使用:0次
2021高三·全国·专题练习
4 . 某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染。流程如下:

写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式___________ ,

写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式
您最近一年使用:0次
名校
5 . 工业上常用FeSO4溶液处理废水中的重铬酸根离子(Cr2O ),反应原理为:6Fe2++Cr2O
),反应原理为:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。处理25.00mL某废水,需消耗15.00mL1.00×10-2mol/LFeSO4溶液(不考虑其他物质与Fe2+反应)。该废水中Cr2O
+14H+=6Fe3++2Cr3++7H2O。处理25.00mL某废水,需消耗15.00mL1.00×10-2mol/LFeSO4溶液(不考虑其他物质与Fe2+反应)。该废水中Cr2O 的物质的量浓度(单位:mol/L)为
的物质的量浓度(单位:mol/L)为
 ),反应原理为:6Fe2++Cr2O
),反应原理为:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。处理25.00mL某废水,需消耗15.00mL1.00×10-2mol/LFeSO4溶液(不考虑其他物质与Fe2+反应)。该废水中Cr2O
+14H+=6Fe3++2Cr3++7H2O。处理25.00mL某废水,需消耗15.00mL1.00×10-2mol/LFeSO4溶液(不考虑其他物质与Fe2+反应)。该废水中Cr2O 的物质的量浓度(单位:mol/L)为
的物质的量浓度(单位:mol/L)为| A.1.50×10-4 | B.6.00×10-4 | C.1.00×10-3 | D.3.60×10-3 |
您最近一年使用:0次
2021-08-07更新
|
1152次组卷
|
11卷引用:2021年7月浙江省普通高中学业水平考试化学试题
2021年7月浙江省普通高中学业水平考试化学试题浙江省宁波市三锋教研联盟2021-2022学年高一上学期11月期中考试化学试题浙江省金华市曙光学校2021-2022学年高一上学期第二次阶段考试化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题上海市曹杨第二中学2022-2023学年高一上学期总结性评价化学试题上海市民立中学2022-2023学年高一上学期期末考试化学试题(已下线)专题03 物质的量的基本计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题(已下线)【2022】【高一化学】【期中考】-182江西省景德镇一中2022-2023学年高二下学期期中考试(18班)化学试题四川省眉山市仁寿县2023-2024学年高一上学期1月期末化学试题
6 . Ⅰ.中学化学中几种常见物质的转化关系如图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:___________
(2)写出反应E+H2O2→F的化学方程式:___________
(3)若反应F+D→E转移的电子数为3.01×1023,则消耗D的质量为___________ g。
Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:___________
(5)把ag的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与bL(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为___________ g。(用a、b的代数式表示)
(6)金属Mg可以在NO2燃烧,产物可能为MgO、Mg3N2和N2.现有13.2g的Mg粉,在足量的NO2中充分燃烧,得到21.0g的固体和1120mL(标准状况)的气体。写出燃烧过程发生的化学方程式:___________

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:
(2)写出反应E+H2O2→F的化学方程式:
(3)若反应F+D→E转移的电子数为3.01×1023,则消耗D的质量为
Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:
(5)把ag的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与bL(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为
(6)金属Mg可以在NO2燃烧,产物可能为MgO、Mg3N2和N2.现有13.2g的Mg粉,在足量的NO2中充分燃烧,得到21.0g的固体和1120mL(标准状况)的气体。写出燃烧过程发生的化学方程式:
您最近一年使用:0次
解题方法
7 . 硼氢化钠(NaBH4)中的氢元素为-1价,具有很强的还原性,被称为“万能还原剂”,NaBH4在催化剂钌(Ru)表面与水反应的历程如图所示:
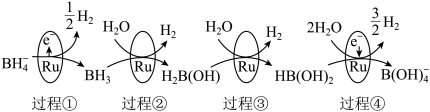
下列说法中错误的是

下列说法中错误的是
| A.过程②反应为BH3+H2O=H2↑+H2B(OH) |
| B.反应过程中硼元素的化合价发生了变化 |
| C.若过程③和过程④均产生lmol H2,则转移电子数目不相等 |
| D.Ru可使上述反应活化分子的百分数提高,加快反应速率 |
您最近一年使用:0次
2021-08-06更新
|
356次组卷
|
2卷引用:九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题
8 . 某化学兴趣小组利用下图所示装置研究了CuC2O4的热分解反应,加热装置已省略,已知N2是保护气不参与反应。下列说法中正确的是


| A.可以将N2换成Cl2而不影响实验结果 |
| B.气体产物中可能只有CO,而无CO2 |
| C.若固体产物是Cu和CuO的混合物,则气体产物全都是CO |
| D.若气体产物只有CO2,则固体产物只有Cu |
您最近一年使用:0次
名校
解题方法
9 . 向一定体积的浓H2SO4中加入0.5 mol Zn后并加热,充分反应后Zn完全溶解,同时收集到两种气体。下列说法中不正确的是
| A.收集到的气体是SO2和H2 |
| B.收集到的气体在标准状况下的体积约为11.2 L |
| C.溶解过程转移电子数为NA |
| D.该反应体现了浓硫酸的强氧化性和吸水性 |
您最近一年使用:0次
2021-08-06更新
|
434次组卷
|
3卷引用:重庆市南开中学2020-2021学年高一下学期期中考试化学试题
重庆市南开中学2020-2021学年高一下学期期中考试化学试题(已下线)4.2.1 含硫物质间的转化-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)重庆市四川外语学院重庆第二外国语学校2021-2022学年高一下学期期中考试化学试题
名校
解题方法
10 . 碘是生命体中的必需元素,碘及其化合物在生活中有重要的用途。
(1). KIO3可作为食盐中的补碘剂,KIO3的化学名称是___________ 。
(2). 实验室中制取少量碘可采用如下方法:KI + CuSO4→ A (白色)↓+ K2SO4+ I2.16.0 g CuSO4与过量KI反应后可得19.1 g 的A,则A的化学式为___________ 。
(3). 全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应为:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。
该反应实质是两步反应,第一步:IO + HSO
+ HSO →SO
→SO + I-+ H+,则第二步反应的离子方程式为
+ I-+ H+,则第二步反应的离子方程式为___________ ;若要使NaIO3的利用率最高,NaIO3在第一步和第二步反应中的用量之比是___________ 。
(4). 碘的纯度分析:精确量取0.1150g精制后的碘置于碘量瓶中,加入KI和水振荡至完全溶解(KI仅用于溶解)。以0.0500mol·L-1的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液17.00mL。则该碘的质量分数为___________ 。(已知:2S2O +I2=2I-+S4O
+I2=2I-+S4O )
)
(5). 单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O H3O++OH-),生成的阳离子为IF
H3O++OH-),生成的阳离子为IF ,则阴离子为
,则阴离子为___________ 。
(1). KIO3可作为食盐中的补碘剂,KIO3的化学名称是
(2). 实验室中制取少量碘可采用如下方法:KI + CuSO4→ A (白色)↓+ K2SO4+ I2.16.0 g CuSO4与过量KI反应后可得19.1 g 的A,则A的化学式为
(3). 全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应为:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。
该反应实质是两步反应,第一步:IO
 + HSO
+ HSO →SO
→SO + I-+ H+,则第二步反应的离子方程式为
+ I-+ H+,则第二步反应的离子方程式为(4). 碘的纯度分析:精确量取0.1150g精制后的碘置于碘量瓶中,加入KI和水振荡至完全溶解(KI仅用于溶解)。以0.0500mol·L-1的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液17.00mL。则该碘的质量分数为
 +I2=2I-+S4O
+I2=2I-+S4O )
)(5). 单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O
 H3O++OH-),生成的阳离子为IF
H3O++OH-),生成的阳离子为IF ,则阴离子为
,则阴离子为
您最近一年使用:0次



