1 . 已知: 易溶于水,
易溶于水, 微溶于水。以含锂的电解铝废渣(主要含
微溶于水。以含锂的电解铝废渣(主要含 、
、 、
、 、
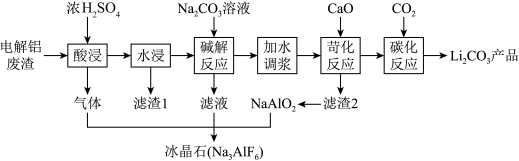
、 )和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
 易溶于水,
易溶于水, 微溶于水。以含锂的电解铝废渣(主要含
微溶于水。以含锂的电解铝废渣(主要含 、
、 、
、 、
、 )和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
A.第一步酸浸时产生气体的化学式为 |
B.滤渣1的成分为 |
C.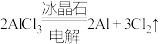 |
D.碳化反应后的溶液得到 的具体实验操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥 的具体实验操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥 |
您最近一年使用:0次
解题方法
2 . 化学与生产、生活密切相关。下列说法不正确的是
A.《美国陶瓷学会会刊》发表我国故宫研究院的考古成果:乾隆时期紫金釉中发现特殊晶体-亚稳相 晶体,该样品溶于盐酸,滴加KSCN溶液,可验证 晶体,该样品溶于盐酸,滴加KSCN溶液,可验证 |
| B.利用酸性重铬酸钾检测酒驾利用了酸性重铬酸钾的强氧化性和酒精的还原性、挥发性 |
| C.石油的分馏,煤的气化、液化均属于物理变化 |
| D.采取“汽车尾气催化净化”“静电除尘”“燃煤固硫”等方法,可提高空气质量 |
您最近一年使用:0次
名校
解题方法
3 . Cu与稀盐酸在持续通入空气的条件下可反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。下列说法正确的是
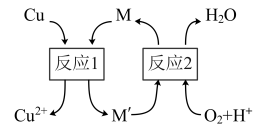

| A.M’在水溶液中呈黄色 |
| B.反应1的离子方程式为Cu+Fe3+=Cu2++Fe2+ |
| C.反应2的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O |
| D.Al3+、Fe3+能催化该反应的本质是它们能降低该反应的活化能 |
您最近一年使用:0次
名校
4 . 海洋资源丰富,海水水资源的利用和海水化学资源(主要为 NaCl 和 MgSO4等物质及K、Br 等元素)的利用具有非常广阔的前景。
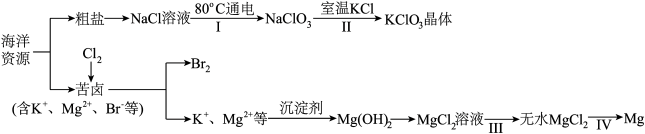
回答下列问题:
(1)Br 元素价电子排布式___________
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)步骤Ⅰ利用电解法制备,写出阳极发生的反应方程式:___________ ,步骤Ⅱ中能析出 KClO3晶体而无其他晶体析出的原因是___________ 。
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式___________ 。
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为___________ 。
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为___________ 。
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式___________ 。

回答下列问题:
(1)Br 元素价电子排布式
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.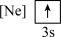 | B.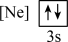 |
C.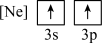 | D.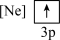 |
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式
您最近一年使用:0次
解题方法
5 . 金属钴(Co)广泛用作电池材料,草酸钴用途广泛,可用于指示剂和催化剂制备。
某工厂以水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:

(1) 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为___________ ,固体1的成分是___________ 。
(2)酸浸过程涉及两个氧化还原反应,写出 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:___________ ,另一个反应中氧化剂与还原剂(均指固体)物质的量之比为___________ 。
(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于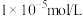 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
___________ ,用NaF沉镁而不是用调pH的方法除镁的原因最可能是___________ {已知常温下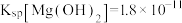 、
、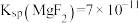 }。
}。
(4) 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:___________ 。
(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式: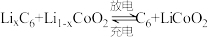 。
。
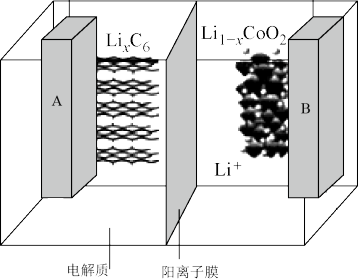
则充电时 从
从___________ (填“A”或“B”)极区移向另一区,阳极上的电极反应式为___________ 。
某工厂以水钴矿(主要成分为
 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:
(1)
 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为(2)酸浸过程涉及两个氧化还原反应,写出
 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于
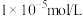 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
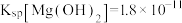 、
、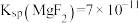 }。
}。(4)
 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式:
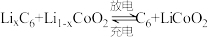 。
。
则充电时
 从
从
您最近一年使用:0次
名校
解题方法
6 . 六聚偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由Ca3(PO4)2、焦炭、石英砂为原料制备六偏磷酸钠的方法如下:
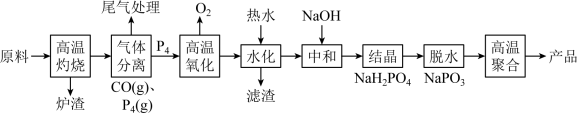
回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是_______ 。
(2)“高温灼烧”发生反应的化学方程式是_______ 。
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是_______ 。
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是_______ 、_______ (填化学式)。
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式_______ 。
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为_______ (结果保留两位小数)。
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是_______ 。

回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是
(2)“高温灼烧”发生反应的化学方程式是
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是
您最近一年使用:0次
名校
7 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用且能够更好地保护环境,请回答下列问题:
(1)工业合成氨为氮肥的生产作出了巨大贡献。 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
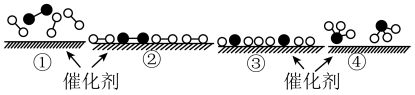
已知工业合成氨: 是一个放热反应。
是一个放热反应。
下列说法正确的是___________。
(2)以下是 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:
①提高该化学反应限度的途径是___________ 。
② 含量达到98.8%的条件是
含量达到98.8%的条件是___________ ,而实际工业生产通常选择温度400~500℃,原因是___________ ,压强选择10MPa~30MPa,原因是___________ 。
(3)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
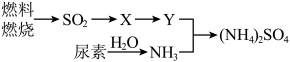
①X可能是 或
或___________ ,Y是___________
②尿素 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为___________ 。
(1)工业合成氨为氮肥的生产作出了巨大贡献。
 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
已知工业合成氨:
 是一个放热反应。
是一个放热反应。下列说法正确的是___________。
| A.使用催化剂,可以加快合成氨的反应速率 |
| B.②→③过程,是吸热过程且只有H-H键断裂 |
C.③→④过程,N原子和H原子形成了含有极性键的 |
| D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:压强/MPa
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②
 含量达到98.8%的条件是
含量达到98.8%的条件是(3)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)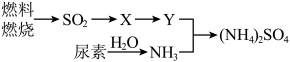
①X可能是
 或
或②尿素
 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . “84”消毒液、双氧水、肥皂水和75%酒精等广泛用作抗击新型冠状病毒的消毒剂。下列说法错误的是
| A.密闭低温贮存双氧水和75%酒精 | B.上述物质都是利用其强氧化性消毒 |
| C.75%酒精的消毒效果比95%酒精的好 | D.鼓励勤用肥皂水洗手并保持室内通风 |
您最近一年使用:0次
名校
解题方法
9 . 钼是电子工业的重要材料,制备它的原料之一是钼铅矿(主要成分是PbMoO4,模拟部分工艺流如图:

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是________ (填化学式)。
(2)写出流程中用热还原法制单质钼的化学方程式________ 。
(3)铵化时,加HNO3的作用是________ 。
(4)检验(NH4)2MoO4晶体洗净的方法是________ 。
(5)可循环利用的物质有________ (填化学式)。
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:________ 。

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是
(2)写出流程中用热还原法制单质钼的化学方程式
(3)铵化时,加HNO3的作用是
(4)检验(NH4)2MoO4晶体洗净的方法是
(5)可循环利用的物质有
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:
您最近一年使用:0次
名校
解题方法
10 . 工业上用黄铁矿 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
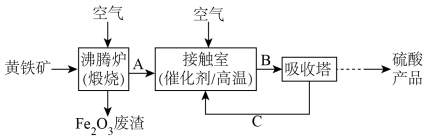
回答下列问题:
(1)在接触室中发生的反应是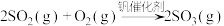 ,该反应属于
,该反应属于_______ (填字母)。
a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为_______ 。
(3)利用 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为_______ 。
(4)我国 排放标准限值为
排放标准限值为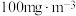 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为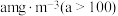 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水_______ L(用含a、b的代数式表示),才能使该烟气 排放值为
排放值为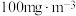 。
。
(5) 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。
(6)大气中的水蒸气在紫外线作用下会转化为活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式_______ 。
 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
回答下列问题:
(1)在接触室中发生的反应是
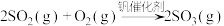 ,该反应属于
,该反应属于a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为
(3)利用
 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为(4)我国
 排放标准限值为
排放标准限值为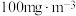 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为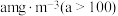 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水 排放值为
排放值为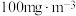 。
。(5)
 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:(6)大气中的水蒸气在紫外线作用下会转化为活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
您最近一年使用:0次



