解题方法
1 . 已知:草酸(H2C2O4)是一种常见的二元弱酸。请回答下列问题。
(1)草酸(H2C2O4)中碳元素的化合价为_______ 。
(2)依据氧化还原反应规律之价态规律可知草酸可能具有_______
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(3)请写出草酸(H2C2O4)在水溶液中的电离方程式_______ 。
(4)请写出草酸(H2C2O4)和氢氧化钠溶液反应的离子方程式_______ 。
(5)请配平草酸溶液和酸性高锰酸钾溶液发生反应的离子方程式 :_____
H2C2O4+ H ++ MnO = Mn2+ + H2O+ CO2↑
= Mn2+ + H2O+ CO2↑
(1)草酸(H2C2O4)中碳元素的化合价为
(2)依据氧化还原反应规律之价态规律可知草酸可能具有
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(3)请写出草酸(H2C2O4)在水溶液中的电离方程式
(4)请写出草酸(H2C2O4)和氢氧化钠溶液反应的离子方程式
(5)请配平草酸溶液和酸性高锰酸钾溶液发生反应的离子方程式 :
H2C2O4+ H ++ MnO
 = Mn2+ + H2O+ CO2↑
= Mn2+ + H2O+ CO2↑
您最近一年使用:0次
名校
解题方法
2 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
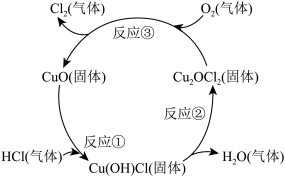
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
396次组卷
|
3卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
3 . 已知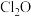 是一种棕黄色的气体,其沸点为
是一种棕黄色的气体,其沸点为 ,易爆炸,室温时开始缓慢分解。一种制备
,易爆炸,室温时开始缓慢分解。一种制备 和次氯酸的实验装置如下:
和次氯酸的实验装置如下:
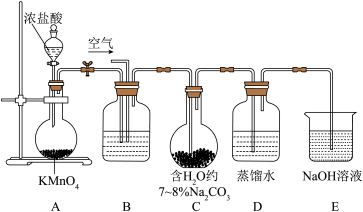
回答下列问题:
(1)写出次氯酸的电子式:_______ 。
(2)装置A烧瓶中发生反应的离子方程式为_______ (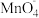 被还原为
被还原为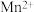 )
)
(3)装置B中盛放的溶液可以是_______ ;为得到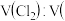 空气
空气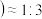 的混合气体,可采用的方法是
的混合气体,可采用的方法是_______ 。
(4)装置C需控制温度在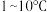 反应,可采取的措施是
反应,可采取的措施是_______ ;烧瓶中 与
与 反应产生
反应产生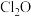 的化学方程式为
的化学方程式为_______ ;用空气稀释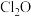 的目的是
的目的是_______ 。
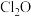 是一种棕黄色的气体,其沸点为
是一种棕黄色的气体,其沸点为 ,易爆炸,室温时开始缓慢分解。一种制备
,易爆炸,室温时开始缓慢分解。一种制备 和次氯酸的实验装置如下:
和次氯酸的实验装置如下:
回答下列问题:
(1)写出次氯酸的电子式:
(2)装置A烧瓶中发生反应的离子方程式为
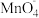 被还原为
被还原为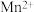 )
)(3)装置B中盛放的溶液可以是
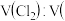 空气
空气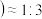 的混合气体,可采用的方法是
的混合气体,可采用的方法是(4)装置C需控制温度在
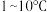 反应,可采取的措施是
反应,可采取的措施是 与
与 反应产生
反应产生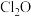 的化学方程式为
的化学方程式为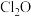 的目的是
的目的是
您最近一年使用:0次
4 . 将Cu与S在隔绝空气的条件下加热且充分反应。下列叙述中,正确的是
| A.生成物中只有Cu2S |
| B.生成物中只有CuS |
| C.生成物中同时存在Cu2S和CuS |
| D.若参加反应的Cu为0.1mol,则有0.2mol电子发生转移 |
您最近一年使用:0次
解题方法
5 . 铁、氯元素的单质及化合物与生产、生活密切相关,请回答下列问题。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有_______ 性,工业盐中毒后,可服用维生素C来缓解中毒状况,说明维生素C具有_______ 性。
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式_______ ,在制备和收集氯气的实验过程中,下列选项正确的是_______ (填字母)。
a.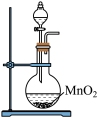 b.
b. 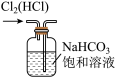 c.
c. 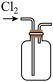 d.
d. 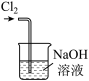
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗_______ molHCl,其中有_______ molHCl被氧化。分别利用二氧化锰和高锰酸钾制备等量的氯气,消耗HCl的物质的量之比为_______ 。
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为_______ 。
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是_______ ,还原剂与氧化剂的质量之比为_______ 。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为_______ 。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式
a.
 b.
b.  c.
c.  d.
d. 
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是
 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
您最近一年使用:0次
6 . 回答下列问题。
(1)过氧化氢(H2O2)的水溶液俗称双氧水,双氧水是一种高效绿色消毒剂,在生活中常用作人体消毒。针对以下①~⑤四个涉及H2O2的反应。
①H2O2+2I—+2H+=I2+2H2O;
②3H2O2+2 =2MnO2↓+3O2↑+2OH—+2H2O;
=2MnO2↓+3O2↑+2OH—+2H2O;
③H2O2+2Fe2++2H+=2Fe3++2H2O;
④2H2O2 O2↑+2H2O;
O2↑+2H2O;
⑤H2O2+SO2=H2SO4
H2O2中O元素的化合价为_______ ,H2O2仅体现还原性的反应是_______ (填序号),H2O2既体现氧化性又体现还原性的反应是_______ (填字母)。
(2)为探究氯化亚铁的性质,某学习小组进行了如下探究。
①溶液配制:配制FeCl2溶液,并加入铁粉,其目的是_______ 。
②科学预测:Fe2+既有氧化性,又有还原性。
③实验探究:实验室提供了下列试剂:0.1mol·L-1FeCl2溶液,新制氯水,KSCN溶液,锌片,铜片,铁粉。根据以上试剂回答:
步骤I:向0.1mol·L-1FeCl2溶液中加入_______ ,可探究FeCl2的还原性,此现象不明显,是因反应产物浓度太低,可在反应后的溶液中再滴入_______ ,看到_______ 现象,证明Fe2+具有还原性。
步骤II:向0.1mol·L-1FeCl2溶液中加入_______ ,可证明Fe2+具有氧化性。
④性质应用:除去FeCl2溶液中少量的FeCl3需加入_______ ,除去FeCl3溶液中少量的FeCl2需加入_______ 。
(1)过氧化氢(H2O2)的水溶液俗称双氧水,双氧水是一种高效绿色消毒剂,在生活中常用作人体消毒。针对以下①~⑤四个涉及H2O2的反应。
①H2O2+2I—+2H+=I2+2H2O;
②3H2O2+2
 =2MnO2↓+3O2↑+2OH—+2H2O;
=2MnO2↓+3O2↑+2OH—+2H2O;③H2O2+2Fe2++2H+=2Fe3++2H2O;
④2H2O2
 O2↑+2H2O;
O2↑+2H2O;⑤H2O2+SO2=H2SO4
H2O2中O元素的化合价为
(2)为探究氯化亚铁的性质,某学习小组进行了如下探究。
①溶液配制:配制FeCl2溶液,并加入铁粉,其目的是
②科学预测:Fe2+既有氧化性,又有还原性。
③实验探究:实验室提供了下列试剂:0.1mol·L-1FeCl2溶液,新制氯水,KSCN溶液,锌片,铜片,铁粉。根据以上试剂回答:
步骤I:向0.1mol·L-1FeCl2溶液中加入
步骤II:向0.1mol·L-1FeCl2溶液中加入
④性质应用:除去FeCl2溶液中少量的FeCl3需加入
您最近一年使用:0次
解题方法
7 . 完成下列题目
(1)某无色溶液中1L含有0.2n个 Ba2+、0.1n个K+和0.2 n个Cl- ,该溶液中还可能含的离子是_______
(2)一定条件下,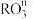 和氟气可发生如下反应:
和氟气可发生如下反应: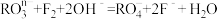 ,由于离子方程式必须遵循电荷守恒,据此可知在RO
,由于离子方程式必须遵循电荷守恒,据此可知在RO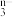 中,n=
中,n=_______ ,元素R的化合价是_______
(3)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、 、
、 (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下:
A+B→白色沉淀 B+ D→白色沉淀 C+D→蓝色沉淀
则A、B、C、D的化学式分别是_______ 、_______ 、_______ 、_______ 。
(1)某无色溶液中1L含有0.2n个 Ba2+、0.1n个K+和0.2 n个Cl- ,该溶液中还可能含的离子是_______
A.0.15n个 | B.0.2n个 | C.0.3n个 | D.0.3n个 |
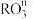 和氟气可发生如下反应:
和氟气可发生如下反应: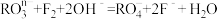 ,由于离子方程式必须遵循电荷守恒,据此可知在RO
,由于离子方程式必须遵循电荷守恒,据此可知在RO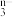 中,n=
中,n=(3)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、
 、
、 (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下:A+B→白色沉淀 B+ D→白色沉淀 C+D→蓝色沉淀
则A、B、C、D的化学式分别是
您最近一年使用:0次
解题方法
8 . 已知某合金由两种金属组成,为测定该合金的成分,某中学化学实验小组采取如下实验方案(每步皆加入足量试剂),根据方案及金属相关性质回答下列问题:

(1)已知向固体A加入氢氧化钠溶液,有气体产生,反应的离子方程式为________ 。
(2)白色沉淀A转化为红褐色沉淀B的方程式为________ 。
(3)在制备白色沉淀A的过程中,为较长时间看到白色沉淀A,下列方法可行的是________ 。
A.将氢氧化钠溶液煮沸除去氧气
B.在溶液A中加入适量植物油以隔绝空气
C.在溶液A、NaOH溶液中通入H2后,迅速混合、密封
(4)固体C的化学式为________ ,加热过程中的方程式为________ 。
(5)为进一步测定该合金的组成,称取13.9g固体溶于足量的盐酸中,待反应完全后向反应后的溶液通入标准状况下2.24LCl2,恰好将溶液中的Fe2+氧化,根据数据回答下列问题:
①合金中各金属的物质的量之比为________ (注明金属顺序);
②转移电子总物质的量为________ 。

(1)已知向固体A加入氢氧化钠溶液,有气体产生,反应的离子方程式为
(2)白色沉淀A转化为红褐色沉淀B的方程式为
(3)在制备白色沉淀A的过程中,为较长时间看到白色沉淀A,下列方法可行的是
A.将氢氧化钠溶液煮沸除去氧气
B.在溶液A中加入适量植物油以隔绝空气
C.在溶液A、NaOH溶液中通入H2后,迅速混合、密封
(4)固体C的化学式为
(5)为进一步测定该合金的组成,称取13.9g固体溶于足量的盐酸中,待反应完全后向反应后的溶液通入标准状况下2.24LCl2,恰好将溶液中的Fe2+氧化,根据数据回答下列问题:
①合金中各金属的物质的量之比为
②转移电子总物质的量为
您最近一年使用:0次
解题方法
9 . 填空
(1)在钢铁厂的生产中,炽热的铁水或者钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,原因是________ (用化学方程式表示)。
(2)由于Na2O2已与CO2、H2O发生反应放出氧气,因此可在呼吸面具或潜水艇中作为氧气的来源,写出Na2O2与H2O反应的化学方程式_________ 。
(3)将Cl2通入冷的石灰乳中,即制得以Ca(ClO)2为有效成分的漂白粉,写出对应的化学方程式________ 。
(4)配平化学方程式:Fe2++ +H+=Fe3++NO↑+H2O。
+H+=Fe3++NO↑+H2O。_______
(5)向一个铝制易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪,再过一会易拉罐又鼓起来恢复原样,写出变瘪的离子方程式___________ 。
(1)在钢铁厂的生产中,炽热的铁水或者钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,原因是
(2)由于Na2O2已与CO2、H2O发生反应放出氧气,因此可在呼吸面具或潜水艇中作为氧气的来源,写出Na2O2与H2O反应的化学方程式
(3)将Cl2通入冷的石灰乳中,即制得以Ca(ClO)2为有效成分的漂白粉,写出对应的化学方程式
(4)配平化学方程式:Fe2++
 +H+=Fe3++NO↑+H2O。
+H+=Fe3++NO↑+H2O。(5)向一个铝制易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪,再过一会易拉罐又鼓起来恢复原样,写出变瘪的离子方程式
您最近一年使用:0次
解题方法
10 . 钛是一种性能非常优越的金属,有着广泛的应用,有人说“21世纪将是钛的世纪”。以金红石矿(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)为主要原料,首先反应生成TiCl4,然后再用镁还原得到金属钛,其工艺流程如下:

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是_________ 。
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是_________ 。工业生产中需要适当补充该物质,该物质可来源于海水,制备过程如下:向海水中加入石灰乳后,向分离得到的固体中加入过量的盐酸,目的是_________ ,将得到的溶液通过_________ 、冷却结晶操作后得到晶体,在HCl气流中加热晶体即可得到该物质。
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:_________ 。
(4)工艺流程中稀有气体Ar的作用是_________ 。
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为_________ mol/L。
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为_________ 。

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:
(4)工艺流程中稀有气体Ar的作用是
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为
您最近一年使用:0次



