1 . 回答下列问题:
(1)下列物质中:①NH3 ②Cu ③乙醇 ④石墨 ⑤熔融NaCl ⑥CuCl2溶液 ⑦Na2O ⑧CO2。
A.属于电解质的是____ (只填序号,下同)。
B.属于非电解质的是____ 。
C.所给状态下能导电的是____ 。
D.既不是电解质,也不是非电解质的纯净物是____ 。
(2)写出下列电解质在水中的电离方程式:
NaHCO3_____ ;
HNO3_____ ;
BaCl2_____ 。
(3)写出下列物质间反应的离子方程式:
氢氧化镁固体溶于足量稀盐酸:____ ;
碳酸氢钠溶液与稀盐酸混合:____ 。
(4)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____ 。
A.Fe B.Fe2+ C.Fe3+
工业上冶炼铁的原理为:Fe2O3+3CO 2Fe+3CO2。该反应中氧化剂是
2Fe+3CO2。该反应中氧化剂是____ (填化学式),碳元素被_____ (填“氧化”或“还原”)。
(5)将宏观和微观联系起来研究物质及其变化是化学的魅力所在。回答下列问题:
a.0.5molH2SO4的质量是____ g,氢原子的数目为____ 个。
b.相同质量的O2,O3,氧原子个数之比为_____ 。
c.含3.01×1023个HCl分子的气体在标准状况下的体积是____ 。
(1)下列物质中:①NH3 ②Cu ③乙醇 ④石墨 ⑤熔融NaCl ⑥CuCl2溶液 ⑦Na2O ⑧CO2。
A.属于电解质的是
B.属于非电解质的是
C.所给状态下能导电的是
D.既不是电解质,也不是非电解质的纯净物是
(2)写出下列电解质在水中的电离方程式:
NaHCO3
HNO3
BaCl2
(3)写出下列物质间反应的离子方程式:
氢氧化镁固体溶于足量稀盐酸:
碳酸氢钠溶液与稀盐酸混合:
(4)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是
A.Fe B.Fe2+ C.Fe3+
工业上冶炼铁的原理为:Fe2O3+3CO
 2Fe+3CO2。该反应中氧化剂是
2Fe+3CO2。该反应中氧化剂是(5)将宏观和微观联系起来研究物质及其变化是化学的魅力所在。回答下列问题:
a.0.5molH2SO4的质量是
b.相同质量的O2,O3,氧原子个数之比为
c.含3.01×1023个HCl分子的气体在标准状况下的体积是
您最近一年使用:0次
2 . 回答下列问题
(1)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应: ,其中被氧化的元素是
,其中被氧化的元素是_______ (填元素名称)。
(2)人体内的铁元素是以 和
和 的形式存在。
的形式存在。 易被人体吸收,服用维生素C,可使
易被人体吸收,服用维生素C,可使 转化成
转化成 ,有利于人体吸收,说明维生素C具有
,有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)现有以下物质:①NaCl晶体 ②液态HCl③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
以上物质中属于电解质的是_______ ,属于非电解质的是_______ 。
(4)一定条件下,酸性KMnO4溶液还可以氧化其他还原性物质。________
_______MnO +_______C2O
+_______C2O +_______=_______Mn2++_______CO2↑+_______(注:C2O
+_______=_______Mn2++_______CO2↑+_______(注:C2O 中的C的化合价为+3价)
中的C的化合价为+3价)
(1)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应:
 ,其中被氧化的元素是
,其中被氧化的元素是(2)人体内的铁元素是以
 和
和 的形式存在。
的形式存在。 易被人体吸收,服用维生素C,可使
易被人体吸收,服用维生素C,可使 转化成
转化成 ,有利于人体吸收,说明维生素C具有
,有利于人体吸收,说明维生素C具有(3)现有以下物质:①NaCl晶体 ②液态HCl③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
以上物质中属于电解质的是
(4)一定条件下,酸性KMnO4溶液还可以氧化其他还原性物质。
_______MnO
 +_______C2O
+_______C2O +_______=_______Mn2++_______CO2↑+_______(注:C2O
+_______=_______Mn2++_______CO2↑+_______(注:C2O 中的C的化合价为+3价)
中的C的化合价为+3价)
您最近一年使用:0次
3 . 氯气是一种重要的化工原料,在生产生活中具有广泛的应用。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式_______ 。若产生标准状况下4.48L ,则反应过程中被氧化的HCl的物质的量是
,则反应过程中被氧化的HCl的物质的量是_______ mol,电子转移_______ mol。
②为了防止氯气污染环境,需将剩余氯气通入_______ ,发生的化学反应方程式_______ 。
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下: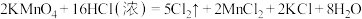 。用双线桥标出该反应的电子转移方向和数目
。用双线桥标出该反应的电子转移方向和数目_______ ;在此反应中浓盐酸中显示出来的性质是_______ (填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。
①若电解饱和食盐水时有117gNaCl被电解,理论上最多可生成氯气_______ 升?(标准状况)
②漂白粉的有效成分是 ,若将标准状况下22.4L的氯气通入足量的石灰乳,理论上可以得到
,若将标准状况下22.4L的氯气通入足量的石灰乳,理论上可以得到
_______ g。干燥的漂白粉不能发挥漂白效果,请写出漂白粉能发挥漂白效果的化学反应方程式_______ 。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式
 ,则反应过程中被氧化的HCl的物质的量是
,则反应过程中被氧化的HCl的物质的量是②为了防止氯气污染环境,需将剩余氯气通入
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
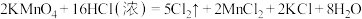 。用双线桥标出该反应的电子转移方向和数目
。用双线桥标出该反应的电子转移方向和数目A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。
①若电解饱和食盐水时有117gNaCl被电解,理论上最多可生成氯气
②漂白粉的有效成分是
 ,若将标准状况下22.4L的氯气通入足量的石灰乳,理论上可以得到
,若将标准状况下22.4L的氯气通入足量的石灰乳,理论上可以得到
您最近一年使用:0次
解题方法
4 . Ⅰ.已知制备Cl2的方法可以为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用双线桥法表示该反应电子转移的方向和数目___________ 。
(2)反应中氧化剂是___________ ,氧化产物是___________ ,被氧化与未被氧化的的HCl质量之比为___________ ;
(3)HCl在上述反应中显示出来的性质是___________;
(4)若有112L(标准状况)Cl2生成,反应中转移电子的数目为___________ 。
Ⅱ.制取新型净水剂高铁酸钠( )原理为:
)原理为:
___________ ___________
___________ ___________ —___________
___________ —___________ ___________
___________ ___________(缺项处填
___________(缺项处填 、
、 或
或 )
)
(5)请配平该化学方程式___________ 。
Ⅲ.NaHCO3是生活中常见的物质,请回答下列问题:
(6)写出NaHCO3在水溶液中的电离方程式:___________ 。
(7)NaHCO3属于“酸”、“碱”、“盐”中的___________ 。
(8)写出NaHCO3溶液与NaOH溶液反应的离子方程式___________ 。
(9)Na2CO3固体中含有少量的NaHCO3杂质,除去杂质发生反应的化学方程式为___________ 。
(1)用双线桥法表示该反应电子转移的方向和数目
(2)反应中氧化剂是
(3)HCl在上述反应中显示出来的性质是___________;
| A.氧化性 | B.还原性 | C.酸性 | D.挥发性 |
Ⅱ.制取新型净水剂高铁酸钠(
 )原理为:
)原理为:___________
 ___________
___________ ___________ —___________
___________ —___________ ___________
___________ ___________(缺项处填
___________(缺项处填 、
、 或
或 )
)(5)请配平该化学方程式
Ⅲ.NaHCO3是生活中常见的物质,请回答下列问题:
(6)写出NaHCO3在水溶液中的电离方程式:
(7)NaHCO3属于“酸”、“碱”、“盐”中的
(8)写出NaHCO3溶液与NaOH溶液反应的离子方程式
(9)Na2CO3固体中含有少量的NaHCO3杂质,除去杂质发生反应的化学方程式为
您最近一年使用:0次
名校
5 . ClO2具有一定的氧化性,是一种优良的消毒剂和果蔬保鲜剂,当温度、浓度过高时均易发生分解,因此常将其制备成NaClO2固体以便运输和贮存。制备NaClO2晶体的实验装置如下图所示。

已知:ClO2熔点:-59℃、沸点:11℃;H2O2沸点:150℃
请回答:
(1)在三颈烧瓶中制备ClO2气体,同时有另外一种单质气体A产生,产物中n(ClO2):n(A)=_______ ;相比于普通的分液漏斗,恒压滴液漏斗其优点是:_______ 。
(2)反应开始时,打开恒压滴液漏斗,滴加双氧水,一段时间后,以适当的流速通入空气将ClO2吹入的H2O2与NaOH溶液混合洗气瓶中,并用冰水浴降温,制备NaClO2晶体。
①当空气流速过慢时,产率会降低,请解释其原因:_______ 。
②仪器A的作用是_______ ;
③制备NaClO2晶体的化学方程式为:_______ 。
④冰水浴的作用是:_______ 、_______ 。
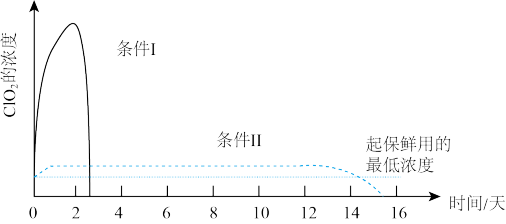
(3)将NaClO2在一定条件下可重新释放ClO2气体,其浓度随时间的变化如图所示,若用于水果保鲜,适宜的条件是_______ 。推测下列物质可以起到与ClO2气体相同保鲜作用的是_______ 。
a.KMnO4溶液 B.NaCl溶液 C.KHSO3溶液

已知:ClO2熔点:-59℃、沸点:11℃;H2O2沸点:150℃
请回答:
(1)在三颈烧瓶中制备ClO2气体,同时有另外一种单质气体A产生,产物中n(ClO2):n(A)=
(2)反应开始时,打开恒压滴液漏斗,滴加双氧水,一段时间后,以适当的流速通入空气将ClO2吹入的H2O2与NaOH溶液混合洗气瓶中,并用冰水浴降温,制备NaClO2晶体。
①当空气流速过慢时,产率会降低,请解释其原因:
②仪器A的作用是
③制备NaClO2晶体的化学方程式为:
④冰水浴的作用是:
(3)将NaClO2在一定条件下可重新释放ClO2气体,其浓度随时间的变化如图所示,若用于水果保鲜,适宜的条件是
a.KMnO4溶液 B.NaCl溶液 C.KHSO3溶液

您最近一年使用:0次
2022-09-21更新
|
186次组卷
|
2卷引用:广东省深圳实验学校2021-2022学年高一上学期第二阶段考试化学试题
名校
6 . 下图是氯元素的“价-类”二维图,据此下列分析正确的是


| A.由“价-类”二维图推测ClONO2具有强氧化性,可与水反应生成两种强酸 |
| B.可用pH试纸分别测定等浓度的HClO2和HClO溶液的pH,比较酸性强弱 |
C.工业上常用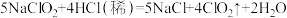 制备ClO2,该反应氧化产物与还原产物之比为4:1 制备ClO2,该反应氧化产物与还原产物之比为4:1 |
| D.常用于炸药、火箭推进剂的某种强氧化剂在“价-类”二维图中的位置为(盐,-1) |
您最近一年使用:0次
2022-09-21更新
|
367次组卷
|
4卷引用:广东省深圳实验学校2021-2022学年高一上学期第二阶段考试化学试题
解题方法
7 . 回答下列问题
(1)3.2g 二氧化硫的物质的量是_______ mol
(2)Na2CO3固体中混有少量NaHCO3,除去杂质的方法是_______ ,反应方程式为_______ ;
(3)用饱和碳酸氢钠溶液除去CO2气体中少量HCl,写出离子化学方程式_______ ,
(4)过氧化钠与水反应的离子方程式_______ 。
(5)7.8g过氧化钠吸收足量的二氧化碳气体,生成氧气在标况下的体积为_______ L
(6)配平下列方程式:______
_______NO + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O
(1)3.2g 二氧化硫的物质的量是
(2)Na2CO3固体中混有少量NaHCO3,除去杂质的方法是
(3)用饱和碳酸氢钠溶液除去CO2气体中少量HCl,写出离子化学方程式
(4)过氧化钠与水反应的离子方程式
(5)7.8g过氧化钠吸收足量的二氧化碳气体,生成氧气在标况下的体积为
(6)配平下列方程式:
_______NO
 + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O
您最近一年使用:0次
解题方法
8 . 下列实验方案及实验结论都正确的是
| 选项 | 实验目的 | 实验方案 | 实验结论 |
| A | 证明 、 、 、 、 的氧化性 的氧化性 | 向 溶液中加入过量HI溶液充分反应后,再滴加KSCN溶液,溶液未变红。 溶液中加入过量HI溶液充分反应后,再滴加KSCN溶液,溶液未变红。 | 氧化性: |
| B | 证明 具有氧化性 具有氧化性 | 向一定量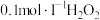 溶液中滴加少量 溶液中滴加少量  溶液,紫色褪去。 溶液,紫色褪去。 |  具有氧化性 具有氧化性 |
| C | 验证铁的吸氧腐蚀 | 在一块已除锈的生铁片上滴1滴含有酚酞的食盐水,静置2~3min,溶液边缘出现红色 | 铁片上发生吸氧腐蚀 |
| D | 配制100mL 的 的 溶液 溶液 | 将16g 溶于水用100mL容量瓶配制溶液 溶于水用100mL容量瓶配制溶液 | 所得溶液浓度为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 草酸(H2C2O4)又称为乙二酸,是一种二元中强酸,主要用作还原剂和漂白剂。将用硫酸酸化的0.2 mol/L KMnO4溶液与0.5 mol/L草酸溶液混合,发现开始一段时间反应速率较慢,溶液褪色不明显,半分钟后,反应速率加快,溶液快速褪色。
(1)已知酸性溶液中KMnO4的还原产物是Mn2+,H2C2O4的氧化产物是CO2。写出上述反应的化学方程式_______ ;
(2)某研究小组欲对产生上述实验现象的影响因素进行探究。
①提出合理假设。
假设1:草酸反应时先电离出C2O ,再与MnO
,再与MnO 反应,硫酸对草酸的电离起抑制作用;
反应,硫酸对草酸的电离起抑制作用;
假设2:_______ ;
假设3:_______ ;
②结合上述假设,设计实验方案进行探究。请在下表中写出对应的实验方案。限选试剂:浓硫酸、MnSO4溶液、石蕊试液、NaOH溶液、蒸馏水。
(3)已知20℃时H2C2O4·2H2O的溶解度是9.5g。该温度下用H2C2O4·2H2O_______ (填“能”或“不能”)配制1.0 mol/L草酸溶液(忽略溶解过程中溶液体积的变化)。
(1)已知酸性溶液中KMnO4的还原产物是Mn2+,H2C2O4的氧化产物是CO2。写出上述反应的化学方程式
(2)某研究小组欲对产生上述实验现象的影响因素进行探究。
①提出合理假设。
假设1:草酸反应时先电离出C2O
 ,再与MnO
,再与MnO 反应,硫酸对草酸的电离起抑制作用;
反应,硫酸对草酸的电离起抑制作用;假设2:
假设3:
②结合上述假设,设计实验方案进行探究。请在下表中写出对应的实验方案。限选试剂:浓硫酸、MnSO4溶液、石蕊试液、NaOH溶液、蒸馏水。
| 实验方案 | 预期现象与结论 |
| 方案1: | 若反应速率减慢,则假设1成立 |
| 方案2: | 若反应速率加快,则假设2成立 |
| 方案3: | 若反应速率加快,则假设3成立 |
您最近一年使用:0次
10 . 高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2O CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______ mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
CoCl2+H2O
 CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为
您最近一年使用:0次



