名校
解题方法
1 . 硫酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物。一片药片所含铁元素60mg,一盒硫酸亚铁片含药100片。
(1)每盒硫酸亚铁中含铁元素的物质的量为_______ mol(结果保留小数点后一位);
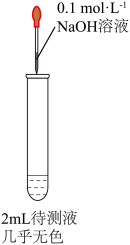
(2)甲同学为检验药片中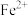 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:_______ ;
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)
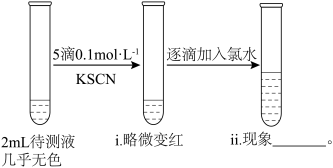
ⅱ中的现象是:_______ ;是由于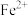 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为_______ ;
(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:_______ 。
(1)每盒硫酸亚铁中含铁元素的物质的量为
(2)甲同学为检验药片中
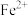 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)

ⅱ中的现象是:
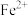 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:
您最近一年使用:0次
2022-12-29更新
|
104次组卷
|
2卷引用:北京市通州区2021-2022学年高一上学期期末测试化学试题
名校
2 . 氧化还原反应和离子反应在化工生产中有重要应用。请运用所学知识回答下列问题:
(1)氰化钠(NaCN)有剧毒,废水中一旦有氰化钠要立即处理。下列物质可以处理氰化钠的是_______(填写序号)。
(2)煤燃烧产生的二氧化硫是大气污染物,常用石灰浆处理,写出反应的化学方程式_______ 。
(3)工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若制得等质量的铀单质,钾、钙、镁三种金属中,消耗质量最多的金属是_______ 。
(4)在一定条件下向废水中加入甲醇(CH3OH被氧化为CO2)能实现硝酸转化为氮气,写出反应的化学方程式_______ ,当有1个硝酸完全转化时,转移的电子数是_______ 。
(5)碳捕集技术是减少二氧化碳排放的一种途径,其基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后生成碳酸盐和碳酸氢盐的物质的量比为1:1,反应的离子方程式是_______ 。
(1)氰化钠(NaCN)有剧毒,废水中一旦有氰化钠要立即处理。下列物质可以处理氰化钠的是_______(填写序号)。
| A.铁粉 | B.过氧化氢溶液 | C.氢氧化钠溶液 | D.次氯酸钠溶液 |
(3)工业上,可以用钾、钙、镁等金属与二氧化铀反应制得铀单质。若制得等质量的铀单质,钾、钙、镁三种金属中,消耗质量最多的金属是
(4)在一定条件下向废水中加入甲醇(CH3OH被氧化为CO2)能实现硝酸转化为氮气,写出反应的化学方程式
(5)碳捕集技术是减少二氧化碳排放的一种途径,其基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后生成碳酸盐和碳酸氢盐的物质的量比为1:1,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 根据题目填写内容
(1)下列物质:①纯H2SO4②硝酸钾溶液③铜④二氧化碳⑤Ba(OH)2固体⑥KHSO4固体⑦蔗糖⑧熔融KCl⑨氨水
能导电的是___________ (填序号,下同),属于电解质的是___________ ,属于非电解质的是_______ 。
检验②中金属阳离子的实验方法是______________________________ (填实验操作的名称)。
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是_____________ 。
Fe(OH)3胶体呈红褐色,具有良好的净水效果。由饱和FeCl3溶液制备Fe(OH)3胶体的方法是_____________ 。
(3)酸性条件下,高锰酸钾可与草酸(H2C2O4)溶液发生反应,其反应如下,补上产物,配平化学方程式,并用单线桥法标出电子转移的方向和数目_____________ 。
____KMnO4+____H2C2O4+____H2SO4→____K2SO4+____MnSO4+____CO2+________
(4)①0.5mol C2H6O的质量是____ 克,含____ 个C2H6O分子,含____ mol氢原子,与____ g H2O分子中的氢的原子数目相同。
②在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为____ 。
③有K2SO4和Al2(SO)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1, 的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为____ 。
(1)下列物质:①纯H2SO4②硝酸钾溶液③铜④二氧化碳⑤Ba(OH)2固体⑥KHSO4固体⑦蔗糖⑧熔融KCl⑨氨水
能导电的是
检验②中金属阳离子的实验方法是
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是
Fe(OH)3胶体呈红褐色,具有良好的净水效果。由饱和FeCl3溶液制备Fe(OH)3胶体的方法是
(3)酸性条件下,高锰酸钾可与草酸(H2C2O4)溶液发生反应,其反应如下,补上产物,配平化学方程式,并用单线桥法标出电子转移的方向和数目
____KMnO4+____H2C2O4+____H2SO4→____K2SO4+____MnSO4+____CO2+________
(4)①0.5mol C2H6O的质量是
②在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为
③有K2SO4和Al2(SO)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,
 的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.7 mol·L-1,,则此溶液中K+的物质的量浓度为
您最近一年使用:0次
4 . 回答下列问题
(1)反应KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O中氧化剂与还原剂物质的量之比为____ 并用双线桥法表示该反应的电子转移情况________ 。
(2)2Na2O2+2H2O=4NaOH+O2↑,每产生标准状况下11.2L氧气时转移电子的数目为____________
(3)11P+15CuSO4+H2O=5Cu3P+6H3PO4+15H2SO4,(Cu3P中P为-3价),被还原的元素是________ ,当有1.5mol CuSO4参加反应时,被氧化的P的物质的量为________ 。
(1)反应KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O中氧化剂与还原剂物质的量之比为
(2)2Na2O2+2H2O=4NaOH+O2↑,每产生标准状况下11.2L氧气时转移电子的数目为
(3)11P+15CuSO4+H2O=5Cu3P+6H3PO4+15H2SO4,(Cu3P中P为-3价),被还原的元素是
您最近一年使用:0次
名校
解题方法
5 . 原子序数依次增大的六种元素X、Y、Z、W、M、R,前五种元素为短周期主族元素,X和Z为同主族元素且可形成离子化合物ZX,X与Y可形成两种常见液体化合物A、B,W的原子序数是Y的原子序数的2倍,R是目前世界上使用最广泛的金属。
(1)M在元素周期表中的位置是___________ ,上述短周期元素中,形成的最高价含氧酸是强酸的元素是___________ (填元素名称)。
(2)A分子中X与Y的原子个数比为1∶1,其分子式为___________ 。
(3)请写出能说明M的非金属性强于W的化学方程式:___________ ;将适量Z的单质置于R形成的高价盐溶液中,总反应的离子方程式为___________ 。
(4)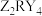 的溶液在存放中会释放出
的溶液在存放中会释放出 、生成红棕色
、生成红棕色 ,同时溶液
,同时溶液 增大,写出反应的化学方程式:
增大,写出反应的化学方程式:___________ 。
(1)M在元素周期表中的位置是
(2)A分子中X与Y的原子个数比为1∶1,其分子式为
(3)请写出能说明M的非金属性强于W的化学方程式:
(4)
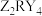 的溶液在存放中会释放出
的溶液在存放中会释放出 、生成红棕色
、生成红棕色 ,同时溶液
,同时溶液 增大,写出反应的化学方程式:
增大,写出反应的化学方程式:
您最近一年使用:0次
2022-12-22更新
|
193次组卷
|
4卷引用:天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题
天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题四川省泸县第五中学2022-2023学年高二上学期期末考试化学试题天津市北辰区四十七中学2022-2023高一上学期期末考试化学试题(已下线)专项02 氧化还原反应的概念、规律及综合应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
解题方法
6 . 在“海带提碘”实验中,通常以四氯化碳为萃取剂对生成的碘单质进行萃取、富集。那么,如何使碘单质从碘的四氯化碳溶液中提取出来呢?某小组查阅资料表明:可采用反萃取法(将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中)。具体步骤如下:

(1)反萃取的第一步在_______ (填仪器名称)中进行,加入浓NaOH溶液后振荡并及时放气,判断碘元素由有机层完全进入水层的现象是_______ ,该步骤发生的离子反应为:_______ 。
(2)将含碘元素的水层从仪器的_______ (填“上”或“下”)口倒入烧杯中,加入45%的H2SO4溶液发生的离子反应为:_______ 。
(3)获得碘单质的传统方法为蒸馏法,已知:I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃,则蒸馏时宜采用_______ 加热(填加热方式),反萃取法较蒸馏法的优点为:_______ (答出一条即可)。

(1)反萃取的第一步在
(2)将含碘元素的水层从仪器的
(3)获得碘单质的传统方法为蒸馏法,已知:I2的沸点184℃,45℃左右就开始缓慢升华,CCl4沸点77℃,则蒸馏时宜采用
您最近一年使用:0次
解题方法
7 . 新冠疫情的发生,消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,而氯气是制取消毒液的重要原料之一。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式___________________________________ ,若收集到标准状况下3.36LCl2,则被氧化的HCl的物质的量为_____________ mol。
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式_______________________________________ ,若要制取1.5L 2 mol/L的84消毒液,则需要标准状况下___________ L 氯气。
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因__________________________________ (用化学方程式表示), 该反应中氧化剂是______________ 。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因
您最近一年使用:0次
8 . 某体系中原有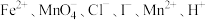 六种微粒,其中某些微粒的物质的量随时间变化的曲线如图所示。下列判断错误的是
六种微粒,其中某些微粒的物质的量随时间变化的曲线如图所示。下列判断错误的是
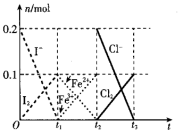
 六种微粒,其中某些微粒的物质的量随时间变化的曲线如图所示。下列判断错误的是
六种微粒,其中某些微粒的物质的量随时间变化的曲线如图所示。下列判断错误的是
A.通过图像可以看出氧化性: |
B.该体系中共发生了3个氧化还原反应,氧化剂均是 |
C. 和 和 时刻的氧化产物均能使湿润的淀粉-KI试纸变蓝 时刻的氧化产物均能使湿润的淀粉-KI试纸变蓝 |
D. 三种微粒的物质的量之比为1:2:2 三种微粒的物质的量之比为1:2:2 |
您最近一年使用:0次
9 . 回答下列问题:
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:__________________ 。
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是______ ,当生成标准状况下33.6L的N2时,转移电子的数目为______ 。
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
(4)在反应2H2S + SO2 = 3S↓ + 2H2O中,氧化产物与还原产物的物质的量之比为______ 。
(5)在强酸性溶液中可发生如下反应:2Mn2++5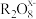 +8H2O=16H++10
+8H2O=16H++10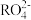 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的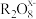 中,x的值是
中,x的值是______ 。
(1)配平并用“双线桥”表示“KMnO4 +H2C2O4+H2SO4→K2SO4 +MnSO4 +CO2↑+H2O”电子转移的方向和数目:
(2)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,被还原的元素是
(3)在肉制品加工中,使用的护色剂——亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是 。
| A.亚硝酸钠是还原剂 | B.维生素C是氧化剂 |
| C.亚硝酸钠被还原 | D.维生素C能把铁离子还原成为亚铁离子 |
(5)在强酸性溶液中可发生如下反应:2Mn2++5
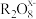 +8H2O=16H++10
+8H2O=16H++10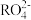 +2
+2 ,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的
,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的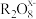 中,x的值是
中,x的值是
您最近一年使用:0次
2022-12-20更新
|
119次组卷
|
2卷引用:四川省遂宁卓同国际学校2021-2022学年高一上学期期中考试化学试题
名校
解题方法
10 . 高锰酸钾是一种强氧化剂,具有很好的消炎、杀菌、抑菌的作用,因此临床上可以用于急性皮炎、湿疹、皮肤感染等疾病的治疗。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的___________ 性。
②高锰酸钾水溶液易变质的原因是___________ 。
③高锰酸钾外用片不可与碘化物接触或并用的原因是___________ 。
(2)将 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为___________ ;当生成0.1mol还原产物时转移电子的数目为___________ 。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
| 【注意事项】 1.本品仅供外用,切忌口服。 2.本品水溶液易变质,故使用前用温水配制,并立即使用。 【药品相互作用】 不可与碘化物、有机物接触或并用,尤其是晶体。 |
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的
②高锰酸钾水溶液易变质的原因是
③高锰酸钾外用片不可与碘化物接触或并用的原因是
(2)将
 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次



