名校
1 . 过氧化锶(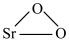 )通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)通常用作分析试剂、氧化剂、漂白剂等。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
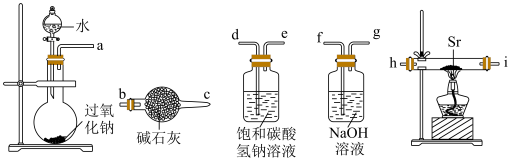
③连接好装置进行实验,实验步骤如下,正确的操作顺序为
a、打开分液漏斗活塞,将水滴入烧瓶中b、检查装置气密性c、在相应装置中装入药品d、加热e、关闭分液漏斗活塞f、停止加热
(2)乙同学在通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
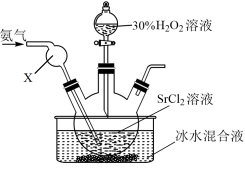
②写出该方法制备SrO2·8H2O的离子方程式
③实验结束后,得到SrO2·8H2O的操作为
(3)除SrO2·8H2O外,请选择下列试剂:FeCl2溶液、HCl溶液、HNO3溶液、KSCN溶液、H2O2溶液设计实验证明SrO2的氧化性比FeCl3的氧化性强:
您最近一年使用:0次
解题方法
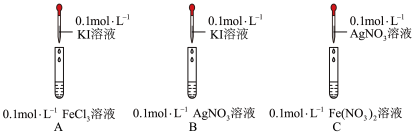
2 . 为探究+1价Ag的氧化性,开展如下活动。
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为_______ 、操作②为_______ 。_______ g固体。
③实验室AgNO3溶液通常盛放在_______ 试剂瓶中。
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:_______ 。
②I、II中的现象说明:_______ 。
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因_______ 。
(3)利用如下图所示装置,探究Ag+氧化I–的反应。_______ 。
A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作_______ 。
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是 氧化了I–,将装置中的
氧化了I–,将装置中的_______ 溶液换成_______ ,闭合K,指针未发生偏转,确认Ag+氧化了I–。
取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。_______ 。
(5)为得到光亮的银镜,实验时应做到:_______ (任写2点)。若黑色沉淀全部转化为银镜,理论上需要乙醛_______ mol。
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为

③实验室AgNO3溶液通常盛放在
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
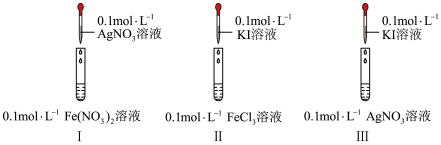
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:
②I、II中的现象说明:
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因
(3)利用如下图所示装置,探究Ag+氧化I–的反应。

A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是
 氧化了I–,将装置中的
氧化了I–,将装置中的取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。
(5)为得到光亮的银镜,实验时应做到:
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组设计如图实验装置(夹持装置已省略),探究 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是__________ 。
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。
①装置A中制备 的离子方程式为
的离子方程式为__________ 。
②证明 的氧化性大于
的氧化性大于 的现象是
的现象是__________ 。
③装置C的作用是__________ ,装置D中所盛试剂为__________ (填化学式)溶液。
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。
① 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
②实验完成后,打开弹簧夹,持续通入 的目的是
的目的是__________ 。
(4)淀粉 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(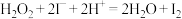 ,
, )。
)。
①滴定终点现象是__________ 。
②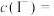
__________  。
。
 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞
 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。①装置A中制备
 的离子方程式为
的离子方程式为②证明
 的氧化性大于
的氧化性大于 的现象是
的现象是③装置C的作用是
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞
 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。①
 发生反应的化学方程式为
发生反应的化学方程式为②实验完成后,打开弹簧夹,持续通入
 的目的是
的目的是(4)淀粉
 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(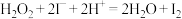 ,
, )。
)。①滴定终点现象是
②
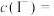
 。
。
您最近一年使用:0次
2024-04-10更新
|
197次组卷
|
3卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
解题方法
4 . 化学是一门以实验为基础的学科。某学习小组探究 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。
(1)用 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有_______ (填名称)。
A中反应的离子方程式为_______ ,说明氧化性: 。
。
(3)甲同学依据B中现象得出 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是_______ 。
(4)已知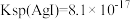 。将
。将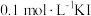 和
和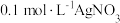 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中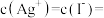
_______  。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
(5)乙同学设计了如图实验:_______ (填“ ”或“
”或“ ”)。
”)。
②K闭合时,指针偏转,“石墨1”电极反应为_______ 。
③丙同学测得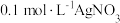 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述_______ (填“左烧杯”或“右烧杯”)中的溶液换成_______ 指针不偏转,丙同学猜想不成立。
综上所述: 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。(1)用
 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有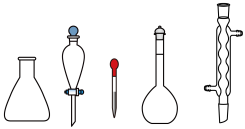
| 实验现象 |
| A中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| B中产生黄色沉淀,滴加淀粉溶液,未变蓝 | |
C中产生黑色沉淀,滴加 溶液,变红 溶液,变红 |
 。
。(3)甲同学依据B中现象得出
 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是(4)已知
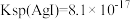 。将
。将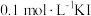 和
和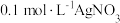 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中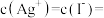
 。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。(5)乙同学设计了如图实验:
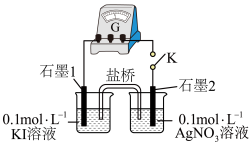
 ”或“
”或“ ”)。
”)。②K闭合时,指针偏转,“石墨1”电极反应为
③丙同学测得
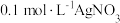 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述综上所述:
 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
您最近一年使用:0次
2024-03-31更新
|
765次组卷
|
3卷引用:广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题
广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题广东省佛山市三水区三水中学2024届高三下学期全真模拟考试化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
5 . 某兴趣小组通过下列实验探究 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
(1)探究 与
与 的氧化性强弱
的氧化性强弱
【实验 】将
】将 溶液和
溶液和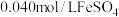 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
_____  (填“>”“<”)。
(填“>”“<”)。
(2)验证反应 是可逆反应
是可逆反应
【实验Ⅱ】
①取实验 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。
②根据实验数据,证明该反应为可逆反应,不需要完成表格中编号_____ 的实验。
(3)测定反应 的平衡常数
的平衡常数
测定方案:通过氧化还原滴定法可测定平衡时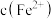 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和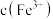 ,进而求算出平衡常数
,进而求算出平衡常数 。
。
【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
上层清液,用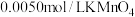 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为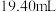 。
。
①用于盛装 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为_____ 。
②平衡时
_____  ,平衡常数
,平衡常数
_____ 。
③若取实验 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值_____ 。
A.偏大 B.偏小 C.无影响 D.无法判断
 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。(1)探究
 与
与 的氧化性强弱
的氧化性强弱【实验
 】将
】将 溶液和
溶液和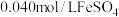 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
 (填“>”“<”)。
(填“>”“<”)。(2)验证反应
 是可逆反应
是可逆反应【实验Ⅱ】
①取实验
 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。| 实验编号 | 操作及现象 | 结论 |
| 1 | 取上层黄色清液,滴加 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 操作及现象是: | 存在 |
| 4 | 取上层清液,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(3)测定反应
 的平衡常数
的平衡常数测定方案:通过氧化还原滴定法可测定平衡时
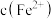 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和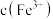 ,进而求算出平衡常数
,进而求算出平衡常数 。
。【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取
 上层清液,用
上层清液,用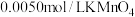 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为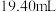 。
。①用于盛装
 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为②平衡时

 ,平衡常数
,平衡常数
③若取实验
 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值A.偏大 B.偏小 C.无影响 D.无法判断
您最近一年使用:0次
名校
6 .  是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
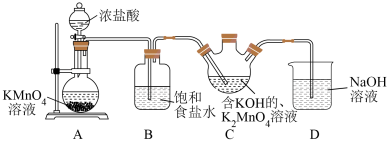
请回答下列问题:
(1)装置A中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ,实验开始前应进行的操作为___________ ,装置D的作用为___________ 。
(2)装置A中浓盐酸在反应中表现出来的性质是___________ 。
(3)由实验推知,A中氧化性:
___________ (填“>”、“<”或“=”) ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色,___________ (填“能”或“不能”)根据此现象判断 的氧化性强于
的氧化性强于 。
。
(4)有关高锰酸钾的实验及现象如表所示。
①已知实验Ⅰ中氧化产物为 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为___________ 。
②实验结论:其他条件相同,介质pH越低, 氧化性越
氧化性越___________ (填“强”或“弱”)。
 是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放
 溶液的仪器名称为
溶液的仪器名称为(2)装置A中浓盐酸在反应中表现出来的性质是
(3)由实验推知,A中氧化性:

 ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色, 的氧化性强于
的氧化性强于 。
。(4)有关高锰酸钾的实验及现象如表所示。
| 实验 | 装置 | 试剂R(5 mL含0.1 mol·L  的溶液) 的溶液) | 现象(通入乙烯的体积相等) |
| Ⅰ | 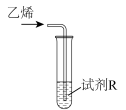 |  溶液 溶液 | 较快产生黑色沉淀 |
| Ⅱ | KOH和 溶液 溶液 | 紫红色溶液较慢变为绿色溶液 | |
| Ⅲ | 稀硫酸和 溶液 溶液 | 紫红色溶液很快变为无色溶液 |
 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为②实验结论:其他条件相同,介质pH越低,
 氧化性越
氧化性越
您最近一年使用:0次
2023-10-27更新
|
253次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
解题方法
7 . 某实验小组学生为探究氧化性: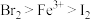 ,设计下列实验方案。
,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
回答下列问题:
(1)利用 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是_____ ,有关反应的离子方程式为_____ 。

(2)利用 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
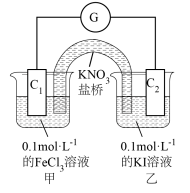
①通过外电路中电流方向:_____ (用 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为_____ 。
(3)有同学认为还可以通过电解反应来证明氧化性: ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
①实验1中,阳极反应式是_____ ,阴极反应式为_____ 。
②实验1、3调节溶液的 宜选用
宜选用_____ (填“硝酸”或“硫酸”)。
③由实验1、2的现象可得出的结论为_____ ;由实验1、3可得出的结论为_____ 。
 ,设计下列实验方案。
,设计下列实验方案。【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型 还原型) 还原型) | 电极电势 |
 / / | 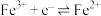 | 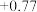 |
 / / |  | 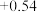 |
 / / |  | 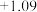 |
(1)利用
 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是
(2)利用
 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电流方向:
 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(3)有同学认为还可以通过电解反应来证明氧化性:
 ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:| 实验 | 电压 |  | 阳极现象 | 阴极现象 |
| 实验1 | 1.5 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 无气泡,银白色金属析出 |
| 实验2 | 3.0 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液显浅红色 溶液显浅红色 | 无气泡,银白色金属析出 |
| 实验3 | 1.5 |  | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 较多气泡,极少量金属析出 |
②实验1、3调节溶液的
 宜选用
宜选用③由实验1、2的现象可得出的结论为
您最近一年使用:0次
解题方法
8 . 实验小组制备高铁酸钾( K2FeO4 )并进行相关探究。
资料:高铁酸钾为紫色固体,极易溶于水,微溶于KOH溶液,难溶于乙醇;在0~5° C、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2;198 °C以上易分解。

请回答下列问题:
(1)制备K2FeO4(夹持装置略)
①实验过程中B装置的作用是_____________________________________ 。
②A装置中发生反应时,氧化剂与还原剂的物质的量之比为___________ 。
③C装置中得到紫色固体和溶液。C装置中Cl2发生的反应有3Cl2 +2Fe(OH)3 +10KOH= 2K2FeO4 + 6KCl+8H2O、______ 。
④将装置C中粗产品溶于冷的KOH溶液,过滤,用无水乙醇洗涤,干燥即得粗产品。选择无水乙醇进行洗涤的优点是_________ (写一条)。
(2)为探究K2FeO4的性质,即证明K2FeO4是否能氧化Cl-而产生Cl2,该实验小组进行了如下实验:
①实验i中产生的“黄绿色气体”中,除含有Cl2,还可能含有____________________ ( 填化学式)。
②实验iii证明a中含有Fe3+,写出相应的操作以及现象:__________________ 。
③能证明K2FeO4氧化了Cl-的实验是____ (填“ i”“ii” “iii”或“iv”)。
④资料表明,酸性溶液中的氧化性 >
>  ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
>  ?若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
?若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______________ 。
资料:高铁酸钾为紫色固体,极易溶于水,微溶于KOH溶液,难溶于乙醇;在0~5° C、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2;198 °C以上易分解。

请回答下列问题:
(1)制备K2FeO4(夹持装置略)
①实验过程中B装置的作用是
②A装置中发生反应时,氧化剂与还原剂的物质的量之比为
③C装置中得到紫色固体和溶液。C装置中Cl2发生的反应有3Cl2 +2Fe(OH)3 +10KOH= 2K2FeO4 + 6KCl+8H2O、
④将装置C中粗产品溶于冷的KOH溶液,过滤,用无水乙醇洗涤,干燥即得粗产品。选择无水乙醇进行洗涤的优点是
(2)为探究K2FeO4的性质,即证明K2FeO4是否能氧化Cl-而产生Cl2,该实验小组进行了如下实验:
实验方案与现象 | |
i | 取适量C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2 |
ii | 取少量a,滴加淀粉KI溶液,无明显现象 |
iii | |
iv | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液 b,取少量b,滴加盐酸,有Cl2产生 |
②实验iii证明a中含有Fe3+,写出相应的操作以及现象:
③能证明K2FeO4氧化了Cl-的实验是
④资料表明,酸性溶液中的氧化性
 >
>  ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
>  ?若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
?若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
名校
9 . 南高实验学习小组经查阅资料发现:K2FeO4(Mr=198)为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。现将他们制备高铁酸钾(K2FeO4),测定其纯度并探究其性质的过程展示如下。
(1)制备K2FeO4(夹持装置略)
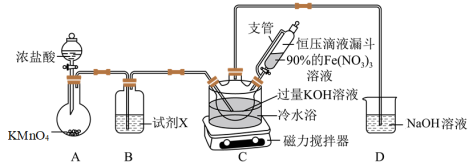
①A为氯气发生装置,盛KMnO4固体的仪器名称是___________ 。
②装置B中所用的试剂X为___________ 。
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式___________ 。
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为___________ (过程中杂质不参与反应)。
(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.方案Ⅰ中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4被Cl-还原得到,还可能由___________ 产生(用离子反应方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,盛KMnO4固体的仪器名称是
②装置B中所用的试剂X为
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO
 +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
解题方法
10 . 某实验小组为探究含硫化合物 的性质,设计如下实验探究
的性质,设计如下实验探究 的氧化性。
的氧化性。
实验操作:向小试管中加入 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1) 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(2)检验该溶液中存在 的具体操作及现象为
的具体操作及现象为___________ 。
(3)实验结论: 的氧化性
的氧化性___________ (填“强于”或“弱于”) 。
。
已知: 可与
可与 发生反应:
发生反应: 。为了进一步探究
。为了进一步探究 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:
(4)上述两实验中均加入了不同体积的蒸馏水,其目的为___________ 。
加入 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1: 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应;
反应;
猜想2: 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。
为验证上述猜想,小组同学补充下表实验:
(5)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同),验证猜想2的实验设计为___________ 。
(6)下层溶液显浅紫色的原因为___________ 。
(7)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 的性质,设计如下实验探究
的性质,设计如下实验探究 的氧化性。
的氧化性。实验操作:向小试管中加入
 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。(1)
 与
与 反应的离子方程式为
反应的离子方程式为(2)检验该溶液中存在
 的具体操作及现象为
的具体操作及现象为(3)实验结论:
 的氧化性
的氧化性 。
。已知:
 可与
可与 发生反应:
发生反应: 。为了进一步探究
。为了进一步探究 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:| 试验编号 |   溶液/ 溶液/ |   溶液/ 溶液/ | 蒸馏水/ | 0.4%的淀粉溶液/滴 |   溶液/ 溶液/ | 变色时间/ |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | 3.0 | 2 | 2.0 | 30 |
加入
 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:猜想1:
 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应;
反应;猜想2:
 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。为验证上述猜想,小组同学补充下表实验:
| 试验编号 |  KI溶液/ KI溶液/ |  碘水/ 碘水/ |   溶液/ 溶液/ |   | 0.4%的淀粉溶液/滴 |   溶液/ 溶液/ | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(6)下层溶液显浅紫色的原因为
(7)由上述实验可知
您最近一年使用:0次
2023-03-18更新
|
988次组卷
|
4卷引用:广东省湛江市2023届高三一模考试化学试题
广东省湛江市2023届高三一模考试化学试题(已下线)广东省湛江市2023届高三下学期普通高考测试(一)化学试题(已下线)专题19 实验综合题湖南省长沙麓山国际实验学校2023-2024学年高二上学期第一次月考化学试题