名校
解题方法
1 . NaBH4(B的化合价为+3)是化工生产中的重要还原剂,其与水发生反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑。下列有关该反应的叙述正确的是
| A.该反应为置换反应 | B.H2O是还原剂 |
| C.NaBH4被氧化 | D.每生成1个H2转移1个电子 |
您最近一年使用:0次
2023-10-05更新
|
43次组卷
|
4卷引用:黑吉两省十校2020-2021学年高一上学期期中联考化学试题
2 . 高锰酸钾是一种典型的强氧化剂。
Ⅰ.用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:
①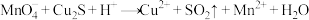 (未配平)
(未配平)
②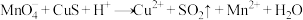 (未配平)
(未配平)
(1)反应①中被氧化的元素是__________ ,氧化剂与还原剂的物质的量之比为__________ 。
(2)当反应①中转移0.8mol电子,生成 的体积为
的体积为__________ L(标准状况下)。
(3)配平并用单线桥法标出反应②中电子转移的方向和数目______________ 。
Ⅱ.在稀硫酸中, 和
和 能发生氧化还原反应:
能发生氧化还原反应:
氧化反应:
还原反应:
(4)写出该氧化还原反应的离子方程式______________________________ 。
(5)反应中若有 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为__________ 。
(6)由上述反应得出物质氧化性强弱的结论是
__________ (填“>”或“<”) 。
。
(7)实验中发现,当加入的少量 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是__________ 。
Ⅰ.用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:①
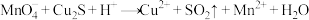 (未配平)
(未配平)②
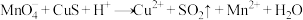 (未配平)
(未配平)(1)反应①中被氧化的元素是
(2)当反应①中转移0.8mol电子,生成
 的体积为
的体积为(3)配平并用单线桥法标出反应②中电子转移的方向和数目
Ⅱ.在稀硫酸中,
 和
和 能发生氧化还原反应:
能发生氧化还原反应:氧化反应:

还原反应:

(4)写出该氧化还原反应的离子方程式
(5)反应中若有
 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为(6)由上述反应得出物质氧化性强弱的结论是

 。
。(7)实验中发现,当加入的少量
 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是
您最近一年使用:0次
名校
解题方法
3 . 计算:
(1) 与浓HCl反应生成KCl、
与浓HCl反应生成KCl、 、
、 、H2O中,请写出对应的具体方程
、H2O中,请写出对应的具体方程_______ 。
(2)被氧化与未被氧化的HCl分子个数比为_______ ,若有73 g HCl参与反应,产生 的质量为
的质量为_______ g。
(1)
 与浓HCl反应生成KCl、
与浓HCl反应生成KCl、 、
、 、H2O中,请写出对应的具体方程
、H2O中,请写出对应的具体方程(2)被氧化与未被氧化的HCl分子个数比为
 的质量为
的质量为
您最近一年使用:0次
名校
解题方法
4 . 已知实验室制取氯气的反应原理为: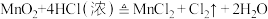 ,据此回答下列问题:
,据此回答下列问题:
(1)其中 发生了
发生了_______ 反应,是_______ 剂;
(2)每4分子氯化氢中只有_______ 分子发生了氧化反应,盐酸是_______ 剂,氧化剂和还原剂个数比是_______ 。
(3)用双线桥法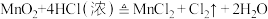 表示电子转移的方向和数目:
表示电子转移的方向和数目:_______ 。
(4)用单线桥法表示 电子转移的方向和数目:
电子转移的方向和数目:_______ 。
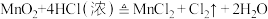 ,据此回答下列问题:
,据此回答下列问题:(1)其中
 发生了
发生了(2)每4分子氯化氢中只有
(3)用双线桥法
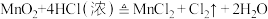 表示电子转移的方向和数目:
表示电子转移的方向和数目:(4)用单线桥法表示
 电子转移的方向和数目:
电子转移的方向和数目:
您最近一年使用:0次
名校
解题方法
5 . 物质的类别和元素的化合价是研究物质性质的两个重要角度。请根据如图1所示,回答下列问题:

(1)欲制备Na2S2O3,从氧化还原角度分析,合理的是______ (填序号)。
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(2)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____ 。
(3)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。
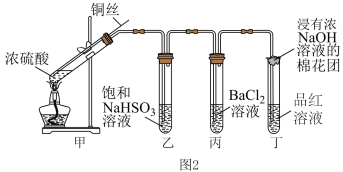
①装置甲中反应的化学方程式是______ 。想要立即终止甲中反应,最恰当的方法是_____ 。
a.上移铜丝使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②在装置丁试管中观察到的现象是______ ,体现了上述产物的_____ 性。
③反应停止后,待装置冷却,把装置丙中试管取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式______ 。

(1)欲制备Na2S2O3,从氧化还原角度分析,合理的是
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(2)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为
(3)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

①装置甲中反应的化学方程式是
a.上移铜丝使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②在装置丁试管中观察到的现象是
③反应停止后,待装置冷却,把装置丙中试管取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式
您最近一年使用:0次
2023-05-09更新
|
52次组卷
|
2卷引用:福建省宁德第一中学2019-2020学年高一下学期第一次月考化学试题
2020高三·全国·专题练习
6 . 将500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0.010 0 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO的体积分数为________ (保留三位有效数字)。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
您最近一年使用:0次
名校
7 . 一定条件下硝酸铵受热分解的化学方程式: ,在反应中被还原与被氧化的氮原子数之比是
,在反应中被还原与被氧化的氮原子数之比是
 ,在反应中被还原与被氧化的氮原子数之比是
,在反应中被还原与被氧化的氮原子数之比是A. | B.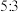 | C.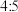 | D.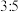 |
您最近一年使用:0次
8 . 工业上制取 的化学反应(未配平):
的化学反应(未配平):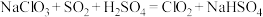 ,下列说法正确的是
,下列说法正确的是
 的化学反应(未配平):
的化学反应(未配平):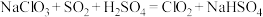 ,下列说法正确的是
,下列说法正确的是A. 在反应中被还原 在反应中被还原 | B. 在反应中失去电子 在反应中失去电子 |
C. 在反应中作氧化剂 在反应中作氧化剂 | D. 氧化剂在反应中得到 氧化剂在反应中得到 电子 电子 |
您最近一年使用:0次
2023-01-06更新
|
425次组卷
|
17卷引用:2015-2016学年河北省隆化县存瑞中学高一上学期第二次月考化学试卷
2015-2016学年河北省隆化县存瑞中学高一上学期第二次月考化学试卷2016-2017学年浙江省绍兴一中高一上期中化学卷2016-2017学年广东省东莞东华中学高一上期中化学卷2016-2017学年新疆兵团第二师华山中学高一上学期期末化学(理)试卷山东省济南第一中学2016-2017学年高二5月学考模拟化学试题河北省唐山市开滦第二中学2016-2017学年高二下学期期末考试化学试题河北省鸡泽县第一中学2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第二章 化学物质及其变化 3.氧化还原反应 氧化剂和还原剂安徽省定远重点中学2017-2018学年高一上学期期末考试化学试题河北省正定县第三中学2018-2019学年高一上学期期中考试化学试题河北省承德市隆化县存瑞中学2018-2019学年高一上学期第二次质检化学试题2020届高三化学大二轮增分强化练——氧化还原反应江西省赣县第三中学2020-2021学年高一上学期10月月考化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高一上学期期末联考化学试题广东省广州市第六中学2022-2023学年高一上学期期末考试化学试题云南省昆明市东川明月中学(原东川区高级中学)2022-2023学年高一上学期期末考试化学试题广东省南阳中学、清新一中、佛冈一中、连州中学、连 山中学五校2022-2023学年高一上学期12月联考化学试题
9 . 一个体重50 kg的健康人体内含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收。所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)维生素C可使食物中的Fe3+转化成Fe2+,在此过程中_______ 是氧化剂,说明维生素C具有_______ 性。
(2)已知下列反应:①H2O2+2Fe3+=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。
反应①中生成1 mol O2转移电子的物质的量为_______ ,反应①、②的总反应方程式为_______ ,在该反应中Fe3+的作用为_______ 。
(1)维生素C可使食物中的Fe3+转化成Fe2+,在此过程中
(2)已知下列反应:①H2O2+2Fe3+=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。
反应①中生成1 mol O2转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
10 . 一定量的Fe、FeO、Fe 2O 3、Fe 3O 4的混合物中加入350mL 2mol/L的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现;若用足量的H 2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.1mol | B.0.225mol | C.0.3mol | D.0.25mol |
您最近一年使用:0次



