名校
1 . i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
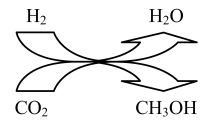
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成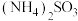 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
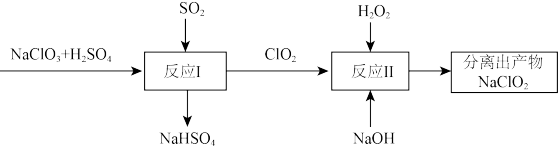
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成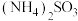 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2022-10-12更新
|
528次组卷
|
3卷引用:辽宁省实验中学2022-2023学年高一上学期10月月考化学试题
解题方法
2 . “价—类”二维图是元素化合物知识结构化的良好工具,有利于变化观念的形成。下图是氮元素的“价—类”二维图。请回答下列问题:

(1)C的化学式是_____ ,肼( )可用作火箭的燃料,其在上图中的字母标号为
)可用作火箭的燃料,其在上图中的字母标号为_____ 。
(2)检验A可使用_______ 试纸。A是重要的化工原料,可以合成多种物质,请写出其在工业上制取D的第1步反应方程式_______ 。
(3)铜和足量的D的稀溶液的反应为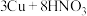 (稀)
(稀)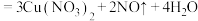 ,当生成11.2L
,当生成11.2L (标准状况)时,转移的电子数目为
(标准状况)时,转移的电子数目为_______ 。反应中D表现的性质为_______ (填标号)。
A.只有还原性 B.还原性和酸性 C.只有强氧化性 D.强氧化性和酸性
(4)一定条件下D分解产生 和另一种气体,写出D分解的化学方程式
和另一种气体,写出D分解的化学方程式_______ 。
(5)若E为硫酸铵,写出以氮气为起始原料制备E的两步制备路线,其它无机试剂任选。_______ (制备路线示例: )
)

(1)C的化学式是
 )可用作火箭的燃料,其在上图中的字母标号为
)可用作火箭的燃料,其在上图中的字母标号为(2)检验A可使用
(3)铜和足量的D的稀溶液的反应为
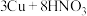 (稀)
(稀)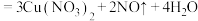 ,当生成11.2L
,当生成11.2L (标准状况)时,转移的电子数目为
(标准状况)时,转移的电子数目为A.只有还原性 B.还原性和酸性 C.只有强氧化性 D.强氧化性和酸性
(4)一定条件下D分解产生
 和另一种气体,写出D分解的化学方程式
和另一种气体,写出D分解的化学方程式(5)若E为硫酸铵,写出以氮气为起始原料制备E的两步制备路线,其它无机试剂任选。
 )
)
您最近一年使用:0次
3 . 化学在“三废”治理方面发挥着重要的作用。回答下列问题:
Ⅰ.制革厂含硫废水中主要含有 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。
(1) 的电子式为
的电子式为___________ ;
(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式___________ 。
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为___________ 。
Ⅱ.工业上用烟气制酸的废料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
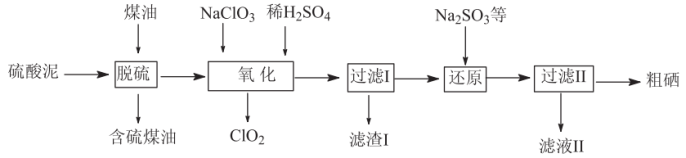
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是___________ 。
(5)“脱硫”过程中,温度控制在95℃,原因是___________ 。
(6)“氧化”过程中,Se转化成弱酸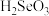 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
Ⅲ.粗硒经过下列流程可获得亚硒酸钠(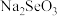 )。
)。
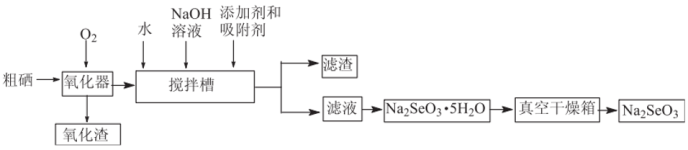
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产___________ t(精确到0.01t)含亚硒酸钠95%的产品。
Ⅰ.制革厂含硫废水中主要含有
 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。(1)
 的电子式为
的电子式为(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的
 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为Ⅱ.工业上用烟气制酸的废料(主要含S、Se、
 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是
(5)“脱硫”过程中,温度控制在95℃,原因是
(6)“氧化”过程中,Se转化成弱酸
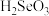 ,该反应的离子方程式为
,该反应的离子方程式为Ⅲ.粗硒经过下列流程可获得亚硒酸钠(
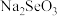 )。
)。
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产
您最近一年使用:0次
名校
4 . 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质。合成路线如下:(设NA为阿伏加德罗常数的值。)
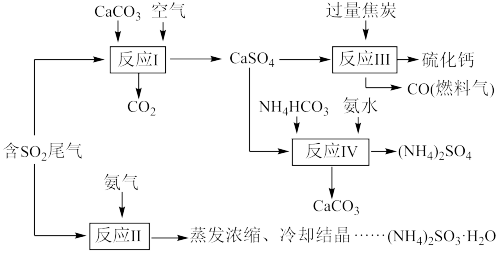
(1)写出反应I的化学方程式_______ 。
(2)反应Ⅲ中每生成1mol硫化钙理论上转移电子数为_______ ;为充分利用副产品CO,工业上常用CO与H2合成甲醇(CH3OH),已知1gCO完全反应生成甲醇气体时放出6.9kJ热量,请写出由CO与H2合成甲醇的热化学方程式:_______ 。
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有_______ 。
(4)根据合成流程,可以循环利用的是_______ 。
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵溶液反应的离子方程式_______ 。

(1)写出反应I的化学方程式
(2)反应Ⅲ中每生成1mol硫化钙理论上转移电子数为
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有
(4)根据合成流程,可以循环利用的是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵溶液反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 氮及其化合物在生产、生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
Ⅰ.某研究性学习小组设计用如图甲所示的实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,回答下列问题:
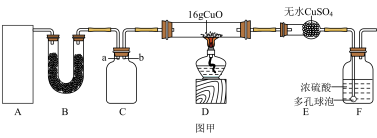
(1)装置C用于收集NH3,应将导管___________ (填“a”或“b”)延长至集气瓶底部。
Ⅱ.以氨气为原料合成硝酸的工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决尾气污染环境问题。
(2)写出氨气在制硝酸过程中发生催化氧化反应的化学方程式___________
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
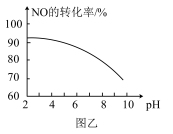
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气须处理达标后才能排放。其中NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液的初始pH(用稀盐酸调节)的变化如图乙所示。
的转化率随NaClO溶液的初始pH(用稀盐酸调节)的变化如图乙所示。
(4)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO ,其离子方程式为
,其离子方程式为___________ 。
(5)NaClO溶液的初始pH越小(c(H+)浓度越大),NO的转化率越高。其原因是___________ 。
Ⅰ.某研究性学习小组设计用如图甲所示的实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,回答下列问题:

(1)装置C用于收集NH3,应将导管
Ⅱ.以氨气为原料合成硝酸的工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决尾气污染环境问题。
(2)写出氨气在制硝酸过程中发生催化氧化反应的化学方程式
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气须处理达标后才能排放。其中NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液的初始pH(用稀盐酸调节)的变化如图乙所示。
的转化率随NaClO溶液的初始pH(用稀盐酸调节)的变化如图乙所示。
(4)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO
 ,其离子方程式为
,其离子方程式为(5)NaClO溶液的初始pH越小(c(H+)浓度越大),NO的转化率越高。其原因是
您最近一年使用:0次
6 . 中国科学院天津工业生物技术研究所在实验室中首次实现从二氧化碳到淀粉分子的全合成,该技术同时解决了粮食危机和气候问题,路线如图所示:

下列说法正确的是:

下列说法正确的是:
A.反应1中,消耗1molCO2转移电子数 |
| B.温度越高,反应②、③的速率一定越快 |
C.将 与足量乙酸发生取代反应,可消耗乙酸 与足量乙酸发生取代反应,可消耗乙酸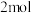 |
| D.在Cu催化条件下也可实现反应② |
您最近一年使用:0次
名校
解题方法
7 . 氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲NH4Cl用与熟石灰反应制取NH3,则甲中的气体发生装置为______ 。(从Ⅱ中选用)
(2)装置丙用于收集NH3,应将导管_____ (填“a”或“b”)延长至集气瓶底部。
Ⅱ.由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3)臭氧脱硝法:O3氧化NO结合水洗,可产生HNO3,该反应的化学方程式为______ 。
(4)氨气催化吸收法处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比______ 。
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2NO +H2O
+H2O
2NO2+2OH-=NO +NO
+NO +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是______ (填化学式)。
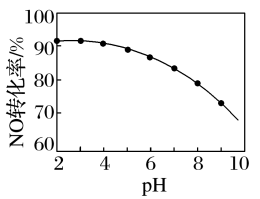
(6)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO ,其离子方程式为
,其离子方程式为______ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是______ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲NH4Cl用与熟石灰反应制取NH3,则甲中的气体发生装置为
(2)装置丙用于收集NH3,应将导管
Ⅱ.由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3)臭氧脱硝法:O3氧化NO结合水洗,可产生HNO3,该反应的化学方程式为
(4)氨气催化吸收法处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2NO
 +H2O
+H2O2NO2+2OH-=NO
 +NO
+NO +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(6)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
2023-03-09更新
|
604次组卷
|
3卷引用:江苏省常州市北郊高级中学2022-2023学年高一下学期3月调研化学试题
名校
8 . 氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
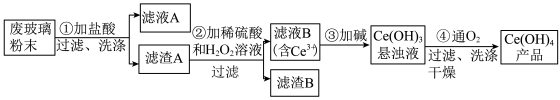
下列说法错误的是

下列说法错误的是
| A.滤渣A中主要含有SiO2、CeO2 |
| B.过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒 |
| C.过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑ |
| D.过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023 |
您最近一年使用:0次
2019-05-31更新
|
1861次组卷
|
12卷引用:河南省商丘市第一高级中学2021-2022学年高一上学期期末考试化学试题
河南省商丘市第一高级中学2021-2022学年高一上学期期末考试化学试题河南省南阳市2021-2022学年高一下学期期终质量评估化学试题 山东省滕州市第一中学2022-2023学年高一下学期6月月考化学试题【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)【新东方】 2020-17四川省成都市实验中学2020届高考化学模拟试卷(二)陕西省安康中学2023届高三第一次检测性考试化学试题湖北省麻城市实验高级中学2021-2022学年高三下学期第一次联考化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)天津市第四十七中学2023-2024学年高三上学期第一次阶段性检测化学试题
9 . 硝酸是重要的化工原料。如图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。_____________ (填序号)。
 .合成氨是一种重要的人工固氮方法
.合成氨是一种重要的人工固氮方法
 .该反应过程中氮元素被氧化
.该反应过程中氮元素被氧化
 .合成的氨气还可以用于化肥工业
.合成的氨气还可以用于化肥工业
 .该反应采用高温、高压等苛刻条件,与
.该反应采用高温、高压等苛刻条件,与 化学性质很稳定有关
化学性质很稳定有关
(2)氨氧化装置中,产生的含氮物质主要为 ,反应的化学方程式为
,反应的化学方程式为_________ 。
(3)聚合、吸收装置中,含氮物质转化的主要反应包括① ;②
;②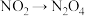 ;③
;③ ,其中属于氧化还原反应的是
,其中属于氧化还原反应的是_________ (填序号)。
(4)吸收装置中,发生的反应为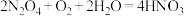 ,若用
,若用 稀硝酸作为吸收液,反应后得到
稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为_________  (写出计算式)。
(写出计算式)。
(5)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:_____________ 。
(6) 催化还原氮氧化物
催化还原氮氧化物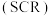 技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示: 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为_________ 。
(7)据报道,意大利科学家获得了极具研究价值的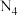 ,其分子结构如图所示。已知:Ⅰ.断裂
,其分子结构如图所示。已知:Ⅰ.断裂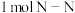 键吸收
键吸收 热量,形成
热量,形成 键放出
键放出 热量
热量
Ⅱ.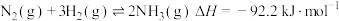
写出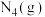 和
和 反应合成
反应合成 的热化学方程式
的热化学方程式_____________________________ 。

 .合成氨是一种重要的人工固氮方法
.合成氨是一种重要的人工固氮方法 .该反应过程中氮元素被氧化
.该反应过程中氮元素被氧化 .合成的氨气还可以用于化肥工业
.合成的氨气还可以用于化肥工业 .该反应采用高温、高压等苛刻条件,与
.该反应采用高温、高压等苛刻条件,与 化学性质很稳定有关
化学性质很稳定有关(2)氨氧化装置中,产生的含氮物质主要为
 ,反应的化学方程式为
,反应的化学方程式为(3)聚合、吸收装置中,含氮物质转化的主要反应包括①
 ;②
;②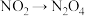 ;③
;③ ,其中属于氧化还原反应的是
,其中属于氧化还原反应的是(4)吸收装置中,发生的反应为
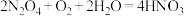 ,若用
,若用 稀硝酸作为吸收液,反应后得到
稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为 (写出计算式)。
(写出计算式)。(5)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:
(6)
 催化还原氮氧化物
催化还原氮氧化物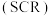 技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示: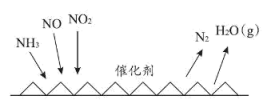
 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为(7)据报道,意大利科学家获得了极具研究价值的
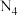 ,其分子结构如图所示。已知:Ⅰ.断裂
,其分子结构如图所示。已知:Ⅰ.断裂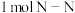 键吸收
键吸收 热量,形成
热量,形成 键放出
键放出 热量
热量Ⅱ.
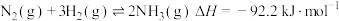
写出
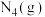 和
和 反应合成
反应合成 的热化学方程式
的热化学方程式
您最近一年使用:0次
名校
解题方法
10 . I.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)NaClO具有较强的_______ (填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式_______ 。
(4)C装置的作用是_______ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成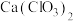 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ 。
②另一个副反应会导致漂白粉中 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为_______ 。
(1)NaClO具有较强的
(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式
(4)C装置的作用是
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
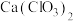 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应会导致漂白粉中
 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为
您最近一年使用:0次



