1 . 次磷酸 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: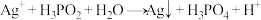 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有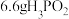 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: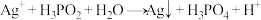 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
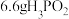 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6 g金属钠投入到足量水中,得a g溶液;将4.8 g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl。若反应中Na2Sx与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把Mn2+离子氧化,若反应后
离子在一定条件下可以把Mn2+离子氧化,若反应后  离子变为
离子变为  离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,Mn2+离子被氧化后的化合价为
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,Mn2+离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解:5NH4NO3=4N2↑+2HNO3+9H2O↑。则该反应中被氧化和被还原的N原子数之比为___________ 。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6 g金属钠投入到足量水中,得a g溶液;将4.8 g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl。若反应中Na2Sx与NaClO的物质的量之比为1:13,则x的值为
(4)
 离子在一定条件下可以把Mn2+离子氧化,若反应后
离子在一定条件下可以把Mn2+离子氧化,若反应后  离子变为
离子变为  离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,Mn2+离子被氧化后的化合价为
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,Mn2+离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:5NH4NO3=4N2↑+2HNO3+9H2O↑。则该反应中被氧化和被还原的N原子数之比为
您最近一年使用:0次
名校
解题方法
3 . I.现有如下物质:①液态氯化氢②氯水③ ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液
(1)这些物质中,属于电解质的是(填编号)_______ 。
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式_______ 。
(3)把少量的④加入⑤中,离子反应方程式为_______ 。
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:_______ 。
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银_______ g。
 ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液(1)这些物质中,属于电解质的是(填编号)
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式
(3)把少量的④加入⑤中,离子反应方程式为
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银
您最近一年使用:0次
名校
解题方法
4 . 汽车排放的尾气中一般含有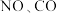 气体,两者均有毒,在催化剂作用下可以反应,生成两种无毒的气体
气体,两者均有毒,在催化剂作用下可以反应,生成两种无毒的气体 和
和 ,反应的化学方程式为
,反应的化学方程式为 (未配平)。回答下列问题:
(未配平)。回答下列问题:
(1)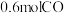 中所含原子数与
中所含原子数与_______  中所含原子数相等。
中所含原子数相等。
(2)该反应中氧化剂为_______ (填化学式),氧化产物与还原产物的质量之比为_______ (填最简整数比)。
(3)配平反应的化学方程式并用双线桥法分析反应中的电子转移:_______ 。
(4)已知:分压 总压
总压 该组分物质的量分数。标准状况
该组分物质的量分数。标准状况 下,由
下,由 和
和 组成的混合气体平均摩尔质量为
组成的混合气体平均摩尔质量为 ,则该混合气体中
,则该混合气体中 和
和 的体积比为
的体积比为_______ ,该体系中 的分压为
的分压为_______ kPa(写表达式,不需计算)。
(5)氧化还原反应可以分解成两个半反应,如 的半反应分别为
的半反应分别为还原反应 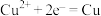 和
和氧化反应 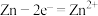 。工业上用
。工业上用 溶液吸收
溶液吸收 尾气的离子方程式为
尾气的离子方程式为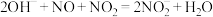 。该反应的氧化反应为
。该反应的氧化反应为_______ 。
(6)呼吸面罩中含有一种淡黄色固体,可以吸收 重新放出
重新放出 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
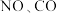 气体,两者均有毒,在催化剂作用下可以反应,生成两种无毒的气体
气体,两者均有毒,在催化剂作用下可以反应,生成两种无毒的气体 和
和 ,反应的化学方程式为
,反应的化学方程式为 (未配平)。回答下列问题:
(未配平)。回答下列问题:(1)
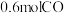 中所含原子数与
中所含原子数与 中所含原子数相等。
中所含原子数相等。(2)该反应中氧化剂为
(3)配平反应的化学方程式并用双线桥法分析反应中的电子转移:
(4)已知:分压
 总压
总压 该组分物质的量分数。标准状况
该组分物质的量分数。标准状况 下,由
下,由 和
和 组成的混合气体平均摩尔质量为
组成的混合气体平均摩尔质量为 ,则该混合气体中
,则该混合气体中 和
和 的体积比为
的体积比为 的分压为
的分压为(5)氧化还原反应可以分解成两个半反应,如
 的半反应分别为
的半反应分别为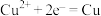 和
和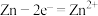 。工业上用
。工业上用 溶液吸收
溶液吸收 尾气的离子方程式为
尾气的离子方程式为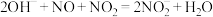 。该反应的氧化反应为
。该反应的氧化反应为(6)呼吸面罩中含有一种淡黄色固体,可以吸收
 重新放出
重新放出 ,写出该反应的化学方程式:
,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . “分类”的思想在化学学习及化学学科发展中起着重要作用。现有下列物质:
① 固体 ②熔融
固体 ②熔融 ③淀粉溶液 ④液态氯化氢 ⑤
③淀粉溶液 ④液态氯化氢 ⑤ 溶液 ⑥
溶液 ⑥ ⑦金属铜 ⑧
⑦金属铜 ⑧ ⑨酒精 ⑩
⑨酒精 ⑩
回答下列问题:
(1)以上物质中属于电解质的是___________ (填序号,下同),属于非电解质的是___________ 。
(2)②熔融 能导电,其电离方程式为
能导电,其电离方程式为___________ 。
(3)③淀粉溶液,⑤ 溶液二者如果混合,可采用
溶液二者如果混合,可采用___________ 方法分离。
(4)⑧ 与水的反应属于氧化还原反应,化学方程式为
与水的反应属于氧化还原反应,化学方程式为___________ ,每当有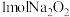 参与反应,转移电子数为
参与反应,转移电子数为___________ (设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
(5)已知⑨ (亚磷酸)与足量
(亚磷酸)与足量 溶液反应的化学方程式为
溶液反应的化学方程式为 ,
, 属于
属于___________ (填“正盐”或“酸式盐”)。
①
 固体 ②熔融
固体 ②熔融 ③淀粉溶液 ④液态氯化氢 ⑤
③淀粉溶液 ④液态氯化氢 ⑤ 溶液 ⑥
溶液 ⑥ ⑦金属铜 ⑧
⑦金属铜 ⑧ ⑨酒精 ⑩
⑨酒精 ⑩
回答下列问题:
(1)以上物质中属于电解质的是
(2)②熔融
 能导电,其电离方程式为
能导电,其电离方程式为(3)③淀粉溶液,⑤
 溶液二者如果混合,可采用
溶液二者如果混合,可采用(4)⑧
 与水的反应属于氧化还原反应,化学方程式为
与水的反应属于氧化还原反应,化学方程式为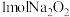 参与反应,转移电子数为
参与反应,转移电子数为 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。(5)已知⑨
 (亚磷酸)与足量
(亚磷酸)与足量 溶液反应的化学方程式为
溶液反应的化学方程式为 ,
, 属于
属于
您最近一年使用:0次
名校
6 . 现有下列10种物质:
① ②
② 溶液 ③液态
溶液 ③液态 ④
④ ⑤
⑤ ⑥
⑥ 固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩
固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩ 溶液
溶液

(1)上述物质中能导电的有___________ (填序号,下同),属于电解质的有___________ 。
(2)向⑧中逐滴加入③的水溶液,该过程中可观察到的现象为___________ 。
(3)向一定浓度的②中滴加⑩,溶液的电导率随滴入溶液体积变化的曲线如图所示。则ab段发生反应的离子方程式为___________ ,c点溶液中大量存在的离子是___________ 。
(4)⑤与⑥在高温下反应生成一种高效绿色消毒剂高铁酸钠,反应方程式为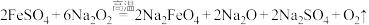 ,若每生成
,若每生成 ,理论上被还原的
,理论上被还原的 的物质的量为
的物质的量为___________ mol。
①
 ②
② 溶液 ③液态
溶液 ③液态 ④
④ ⑤
⑤ ⑥
⑥ 固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩
固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩ 溶液
溶液
(1)上述物质中能导电的有
(2)向⑧中逐滴加入③的水溶液,该过程中可观察到的现象为
(3)向一定浓度的②中滴加⑩,溶液的电导率随滴入溶液体积变化的曲线如图所示。则ab段发生反应的离子方程式为
(4)⑤与⑥在高温下反应生成一种高效绿色消毒剂高铁酸钠,反应方程式为
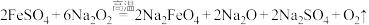 ,若每生成
,若每生成 ,理论上被还原的
,理论上被还原的 的物质的量为
的物质的量为
您最近一年使用:0次
2024-02-07更新
|
124次组卷
|
2卷引用:安徽师范大学附属中学2023-2024学年高一下学期3月阶段性教学质量监测化学试题
7 . “环境就是民生,青山就是美丽、蓝天也是幸福”。回答下列问题:
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是___________ 。
②某团队设计处理流程如下:
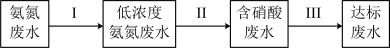
过程Ⅱ为硝化过程,在微生物的作用下实现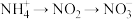 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为___________ ;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现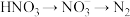 的转化,反应的化学方程式为
的转化,反应的化学方程式为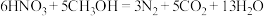 ,氧化产物是
,氧化产物是___________ ,当有1mol硝酸完全转化时,转移的电子数目为___________ 。
(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为___________ 。也可用NaClO2在酸性条件下氧化处理SO2,反应的离子方程式是___________ 。
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
引起雨水pH变化的主要原因是___________ (用化学方程式表示)。
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为___________ 。
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是②某团队设计处理流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现
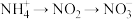 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现
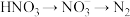 的转化,反应的化学方程式为
的转化,反应的化学方程式为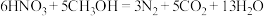 ,氧化产物是
,氧化产物是(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 现有以下物质:ⅰ. 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。
回答下列问题:
(1)以上物质属于电解质的有_______ (填编号,下同),能导电的有_______ 。
(2)写出物质ⅷ的电离方程式:________ 。
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为________ 。
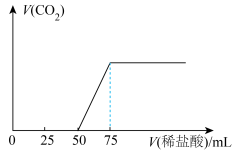
(4)向 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是_______ (填化学式),原 物质ix的浓度为
物质ix的浓度为______ 。
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下: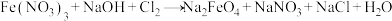
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:________ 。
②该反应中 是
是________ (填“氧化剂”“还原剂”“氧化产物”或“还原产物”)。
③生成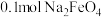 时,转移电子的数自为
时,转移电子的数自为____  (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗___ 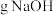 。
。
 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。回答下列问题:
(1)以上物质属于电解质的有
(2)写出物质ⅷ的电离方程式:
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为
(4)向
 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是 物质ix的浓度为
物质ix的浓度为
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下:
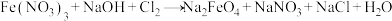
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:
②该反应中
 是
是③生成
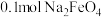 时,转移电子的数自为
时,转移电子的数自为 (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗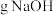 。
。
您最近一年使用:0次
2024-01-30更新
|
57次组卷
|
2卷引用:安徽省阜阳市2023-2024学年高一上学期期末联考化学试卷
名校
9 . 氧化还原反应在生产、生活和生命活动中起着十分重要的作用。例如,饮用水处理和污水净化问题中就广泛应用了氧化还原反应的原理。
I.高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为: 。
。
(1)在 中,
中, 的化合价为
的化合价为___________ 价;上述反应中,每生成 ,有
,有___________  电子转移。
电子转移。
(2)制备 的另外一种方法是在碱性条件下用
的另外一种方法是在碱性条件下用 和
和 反应,请写出相关的离子方程式:
反应,请写出相关的离子方程式:___________ 。
Ⅱ.含氯消毒剂在自来水净化过程中也起到了重要作用。
(3)很多自来水厂用氯气来杀菌、消毒,实验室不能用自来水配制硝酸银溶液,用离子方程式表示其原因___________ 。
(4)亚氯酸钠 是一种高效的漂白剂和氧化剂,其制备方法如下:
是一种高效的漂白剂和氧化剂,其制备方法如下: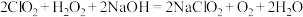 ,从上述反应中可知氧化性较强的是
,从上述反应中可知氧化性较强的是___________ (填“二氧化氯”或“氧气”)。
(5)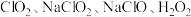 都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
I.高铁酸钠
 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为: 。
。(1)在
 中,
中, 的化合价为
的化合价为 ,有
,有 电子转移。
电子转移。(2)制备
 的另外一种方法是在碱性条件下用
的另外一种方法是在碱性条件下用 和
和 反应,请写出相关的离子方程式:
反应,请写出相关的离子方程式:Ⅱ.含氯消毒剂在自来水净化过程中也起到了重要作用。
(3)很多自来水厂用氯气来杀菌、消毒,实验室不能用自来水配制硝酸银溶液,用离子方程式表示其原因
(4)亚氯酸钠
 是一种高效的漂白剂和氧化剂,其制备方法如下:
是一种高效的漂白剂和氧化剂,其制备方法如下: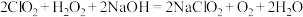 ,从上述反应中可知氧化性较强的是
,从上述反应中可知氧化性较强的是(5)
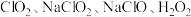 都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)A. | B. | C. | D. |
您最近一年使用:0次
名校
10 . 氧化还原反应原理在研究物质性质及物质转化等方面具有重要的价值。回答下列问题:
(1)按照不同的分类方法将下列化学反应进行分类。
a.
b.
c.
d.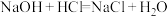
e.
其中属于氧化还原反应,但不属于四大基本反应类型的是___________ (填字母)。
(2)用惰性电极电解饱和食盐水可以得到 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
(3)亚硝酸钠 具有致癌作用,许多腌制食品中含
具有致癌作用,许多腌制食品中含 。酸性
。酸性 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为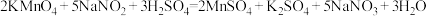 ,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:
,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:___________ 。
(4)新储氢材料-碳纳米管可利用电弧法合成,合成过程中会伴随大量的碳纳米颗粒杂质,这种碳纳米颗粒杂质可用氧化气化法提纯,反应方程式为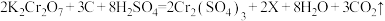
①该反应中,生成物 的化学式为
的化学式为___________ ;
②该反应中,氧化剂为___________ (填化学式),被氧化的元素为___________ (填元素符号);
③该反应中, 表现出
表现出___________ (填字母);
A.酸性 B.还原性 C.氧化性
④该反应中,每生成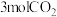 ,转移
,转移___________  电子。
电子。
(1)按照不同的分类方法将下列化学反应进行分类。
a.

b.

c.

d.
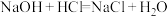
e.

其中属于氧化还原反应,但不属于四大基本反应类型的是
(2)用惰性电极电解饱和食盐水可以得到
 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(3)亚硝酸钠
 具有致癌作用,许多腌制食品中含
具有致癌作用,许多腌制食品中含 。酸性
。酸性 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为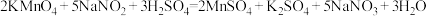 ,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:
,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:(4)新储氢材料-碳纳米管可利用电弧法合成,合成过程中会伴随大量的碳纳米颗粒杂质,这种碳纳米颗粒杂质可用氧化气化法提纯,反应方程式为
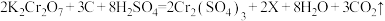
①该反应中,生成物
 的化学式为
的化学式为②该反应中,氧化剂为
③该反应中,
 表现出
表现出A.酸性 B.还原性 C.氧化性
④该反应中,每生成
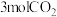 ,转移
,转移 电子。
电子。
您最近一年使用:0次



