1 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: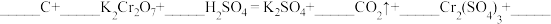
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
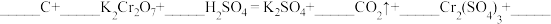
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
解题方法
2 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)合成塔中生成NH3,说明N2具有_____ (填“氧化性”或“还原性”)。
(2)下列有关NH3的说法中,正确的是_____(填字母)。
(3)氨气在氧化炉中发生反应的化学方程式为_____ 。
(4)工厂生产出的浓硝酸可用铝槽车或铁槽车来运输,是因为在常温下,浓硝酸能使铝、铁等发生_____ 现象,说明浓硝酸具有很强的_____ 性。
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出:
①下列环境问题与氮的氧化物排放有关的是_____ ;
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
②为消除它们对环境的污染,可用NH3处理,已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。

(1)合成塔中生成NH3,说明N2具有
(2)下列有关NH3的说法中,正确的是_____(填字母)。
| A.工业合成NH3需要在高温、高压、催化剂下进行 |
| B.NH3可用来生产碳铵和尿素等化肥 |
| C.NH3可用浓硫酸或无水氯化钙干燥 |
| D.NH3受热易分解,须置于冷暗处保存 |
(3)氨气在氧化炉中发生反应的化学方程式为
(4)工厂生产出的浓硝酸可用铝槽车或铁槽车来运输,是因为在常温下,浓硝酸能使铝、铁等发生
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出:
①下列环境问题与氮的氧化物排放有关的是
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
②为消除它们对环境的污染,可用NH3处理,已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
解题方法
3 . I.物质间的转化在生产生活中有着广泛的应用。
A、B、C是中学化学常见的三种物质,它们的相互转化关系如图所示(部分反应条件及产物略去)。
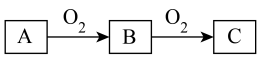
(1)若 是一种活泼金属,
是一种活泼金属, 是淡黄色固体,试用化学方程式表示该物质
是淡黄色固体,试用化学方程式表示该物质 的一个重要应用
的一个重要应用___________ 。将 长期露置于空气中,最后将变成物质
长期露置于空气中,最后将变成物质 的化学式为
的化学式为___________ 。现有 和
和 的固体混合物
的固体混合物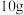 ,加热至质量不再改变,剩余固体质量为
,加热至质量不再改变,剩余固体质量为 的质量分数为
的质量分数为___________ 。
Ⅱ.金属及其化合物在生产生活中有着广泛的应用。
(2)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现___________ 性;___________ (填“能”或“不能”)用氢氧化钠溶液代替。
(3)将 与稀硫酸混合不能反应,但滴入
与稀硫酸混合不能反应,但滴入 后,溶液很快变成蓝色,写出该反应的化学方程式
后,溶液很快变成蓝色,写出该反应的化学方程式___________ 。
(4)利用 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为___________ 。
A、B、C是中学化学常见的三种物质,它们的相互转化关系如图所示(部分反应条件及产物略去)。

(1)若
 是一种活泼金属,
是一种活泼金属, 是淡黄色固体,试用化学方程式表示该物质
是淡黄色固体,试用化学方程式表示该物质 的一个重要应用
的一个重要应用 长期露置于空气中,最后将变成物质
长期露置于空气中,最后将变成物质 的化学式为
的化学式为 和
和 的固体混合物
的固体混合物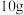 ,加热至质量不再改变,剩余固体质量为
,加热至质量不再改变,剩余固体质量为 的质量分数为
的质量分数为Ⅱ.金属及其化合物在生产生活中有着广泛的应用。
(2)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(3)将
 与稀硫酸混合不能反应,但滴入
与稀硫酸混合不能反应,但滴入 后,溶液很快变成蓝色,写出该反应的化学方程式
后,溶液很快变成蓝色,写出该反应的化学方程式(4)利用
 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
您最近一年使用:0次
4 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)Na2O2的电子式为_______ 。Na2O2可作供氧剂,写出Na2O2与CO2反应的化学方程式_______ 。若有1molNa2O2参加反应则转移电子的物质的量为_______ mol。
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过_______ 、_______ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为_______ g。
(1)Na2O2的电子式为
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为
您最近一年使用:0次
名校
解题方法
5 . Ⅰ硒(Se)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的废渣中提取而得。
(1)Se在元素周期表中位置表示为__________ 。
(2)写出 的电子式:
的电子式:__________ , 的结构式:
的结构式:__________ 。
(3)用电子式表示 的形成过程:
的形成过程:__________ 。
Ⅱ某学习小组探究B及其化合物的性质。
(4)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
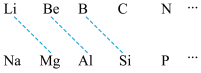
B最高价氧化物的化学式为__________ ,与氢氧化钠溶液反应的化学方程式为__________ 。
(5)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
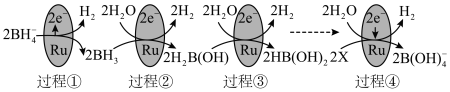
①上图中X的化学式为__________ 。
②图中反应的总化学方程式为__________ 。
③__________  的还原能力与标准状况下
的还原能力与标准状况下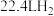 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)Se在元素周期表中位置表示为
(2)写出
 的电子式:
的电子式: 的结构式:
的结构式:(3)用电子式表示
 的形成过程:
的形成过程:Ⅱ某学习小组探究B及其化合物的性质。
(4)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B最高价氧化物的化学式为
(5)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②图中反应的总化学方程式为
③
 的还原能力与标准状况下
的还原能力与标准状况下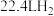 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
名校
6 . 含氨污染物治理及其回收利用是重要课题。
(1)用碱液脱硝是目前研究的课题之一。将 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致___________ 。若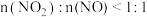 ,则会导致
,则会导致___________ 。
(2)用尿素 (N元素为
(N元素为 价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与
价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与 反应转化成无毒气体,该反应的化学方程式:
反应转化成无毒气体,该反应的化学方程式:___________ 。
(3)工业上在催化剂作用下用 还原工业废气中所含少量
还原工业废气中所含少量 生成
生成 和
和 达到脱除目的,但当温度高于
达到脱除目的,但当温度高于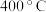 时,
时, 脱除率下降,原因可能是
脱除率下降,原因可能是___________ 。
(4)用纳米铁粉处理废水中的 :
:
①酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是___________ 。
②研究发现,废水中溶解氧会对 的去除产生一定影响。在初始
的去除产生一定影响。在初始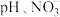 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下
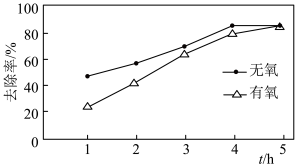
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是___________ 。
(5)将 铜与
铜与 一定浓度的硝酸反应,铜完全溶解,产生的气体为
一定浓度的硝酸反应,铜完全溶解,产生的气体为 和
和 混合气体,其在标准状况下的体积为
混合气体,其在标准状况下的体积为 ,则混合气体中
,则混合气体中 的体积为
的体积为___________ 。(写出计算过程)
(1)用碱液脱硝是目前研究的课题之一。将
 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致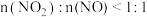 ,则会导致
,则会导致(2)用尿素
 (N元素为
(N元素为 价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与
价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与 反应转化成无毒气体,该反应的化学方程式:
反应转化成无毒气体,该反应的化学方程式:(3)工业上在催化剂作用下用
 还原工业废气中所含少量
还原工业废气中所含少量 生成
生成 和
和 达到脱除目的,但当温度高于
达到脱除目的,但当温度高于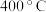 时,
时, 脱除率下降,原因可能是
脱除率下降,原因可能是(4)用纳米铁粉处理废水中的
 :
:①酸性条件下,纳米铁粉与废水中
 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是②研究发现,废水中溶解氧会对
 的去除产生一定影响。在初始
的去除产生一定影响。在初始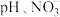 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是
(5)将
 铜与
铜与 一定浓度的硝酸反应,铜完全溶解,产生的气体为
一定浓度的硝酸反应,铜完全溶解,产生的气体为 和
和 混合气体,其在标准状况下的体积为
混合气体,其在标准状况下的体积为 ,则混合气体中
,则混合气体中 的体积为
的体积为
您最近一年使用:0次
7 . 某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式:_____ 。
(2)该反应中氧化剂是_____ ,氧化产物是_____ 。
(3)产生1个O2,转移的电子的个数为_____ 个。
(4)用单线桥标出该反应中电子转移情况:_____ 。
(1)写出该反应的化学方程式:
(2)该反应中氧化剂是
(3)产生1个O2,转移的电子的个数为
(4)用单线桥标出该反应中电子转移情况:
您最近一年使用:0次
名校
解题方法
8 . NOx是污染性气体,其性质的掌握及防污处理很重要。回答下列问题:
(1)写出NO2与水反应的离子方程式:___________ ,该反应中氧化剂与还原剂的质量比为____________ 。
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为___________ mL(答出所有可能)。
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知: 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足__________ 。
(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为_______________ 。
②写出“催化反应”过程中NH3还原NOx的化学方程式:__________ 。
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和_____________________ 。
(1)写出NO2与水反应的离子方程式:
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知:
 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为
②写出“催化反应”过程中NH3还原NOx的化学方程式:
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近一年使用:0次
名校
9 . 工业或机动车尾气中的 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。
(1)碱液吸收:石灰乳可吸收硝酸工业的尾气(含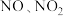 ),获得副产品
),获得副产品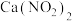 。
。
①等物质的量 与
与 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为___________ 。
②下列措施能提高尾气中 和
和 去除率的有
去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
③该工艺需控制 和
和 的物质的量之比接近
的物质的量之比接近 ,若
,若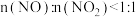 ,则会导致
,则会导致___________ ;若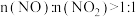 ,则会导致
,则会导致___________ 。
④生产中需保持弱碱性,在酸性溶液中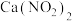 会发生分解,产物之一是
会发生分解,产物之一是 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(2)还原法:尿素水溶液热解产生的氨气发生催化反应可去除尾气中的 。
。 与
与 转化生成
转化生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
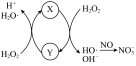
(3)氯化法:“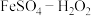 ”试剂可将
”试剂可将 氧化为可溶的
氧化为可溶的 。
。 催化
催化 分解产生有很强的氧化性的
分解产生有很强的氧化性的 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为___________ 。
 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。(1)碱液吸收:石灰乳可吸收硝酸工业的尾气(含
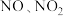 ),获得副产品
),获得副产品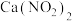 。
。①等物质的量
 与
与 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为②下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液③该工艺需控制
 和
和 的物质的量之比接近
的物质的量之比接近 ,若
,若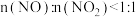 ,则会导致
,则会导致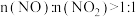 ,则会导致
,则会导致④生产中需保持弱碱性,在酸性溶液中
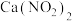 会发生分解,产物之一是
会发生分解,产物之一是 ,其反应的离子方程式为
,其反应的离子方程式为(2)还原法:尿素水溶液热解产生的氨气发生催化反应可去除尾气中的
 。
。 与
与 转化生成
转化生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。(3)氯化法:“
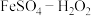 ”试剂可将
”试剂可将 氧化为可溶的
氧化为可溶的 。
。 催化
催化 分解产生有很强的氧化性的
分解产生有很强的氧化性的 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
您最近一年使用:0次
名校
解题方法
10 . 在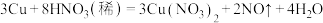 反应中,
反应中,
(1)用双线桥表示电子的转移情况_______
(2)_______ 是氧化剂;_______ 元素被氧化;氧化剂与还原剂的物质的量之比是_______ ;
(3)写出该反应的离子方程式_______ 。
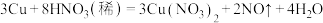 反应中,
反应中,(1)用双线桥表示电子的转移情况
(2)
(3)写出该反应的离子方程式
您最近一年使用:0次



