1 . 二氧化氯(ClO2)是国际公认的广谱、高效和安全的杀菌剂。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:________ 。
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是____ ,氧化产物是_____ 。
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为________ 。
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的_____ 倍(保留2位小数)。
(5)若以NaClO2为原料制备ClO2,需要加入具有____ (填“氧化性”或“还原性”)的物质。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的
(5)若以NaClO2为原料制备ClO2,需要加入具有
您最近一年使用:0次
名校
2 . 硫化氢(H2S)是一种有毒气体,高于200℃分解,溶于水显弱酸性,脱除H2S的方法很多。
(1)Na2CO3吸收H2S。含H2S的气体与饱和Na2CO3溶液在吸收塔内逆流接触,生成两种酸式盐。该反应的离子方程式为___________ 。
(2)干法脱硫技术。
①铁系脱硫剂:活性氧化铁(Fe2O3•H2O)是经典而有效的脱硫剂,脱硫反应:Fe2O3•H2O+H2S→FeS+S+H2O,再生反应:FeS+H2O+O2→Fe2O3•H2O+S(脱硫反应和再生反应均未配平)。
a.Fe2O3•H2O在该反应中的作用可描述为___________ 。
b.若处理标况下4.48LH2S时,理论上消耗O2的物质的量为___________ 。
②锌系脱硫剂:550℃时,将H2S和还原性气体H2按一定比例混合,以一定的流速通过装有锌的复合金属脱硫剂(ZnFe2O4)的反应器,脱硫过程中,ZnFe2O4与H2S、H2反应生成了ZnS、FeS和H2O,其化学方程式为___________ 。
(3)生物脱硫技术。
天然气是一种重要的化工原料和燃料,常含有少量H2S。H2S与碱反应转化为HS‒,在脱氮硫杆菌参与下,HS‒被NO 氧化为SO
氧化为SO 、NO
、NO 被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO
被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO 的物质的量为
的物质的量为___________ mol。
(1)Na2CO3吸收H2S。含H2S的气体与饱和Na2CO3溶液在吸收塔内逆流接触,生成两种酸式盐。该反应的离子方程式为
(2)干法脱硫技术。
①铁系脱硫剂:活性氧化铁(Fe2O3•H2O)是经典而有效的脱硫剂,脱硫反应:Fe2O3•H2O+H2S→FeS+S+H2O,再生反应:FeS+H2O+O2→Fe2O3•H2O+S(脱硫反应和再生反应均未配平)。
a.Fe2O3•H2O在该反应中的作用可描述为
b.若处理标况下4.48LH2S时,理论上消耗O2的物质的量为
②锌系脱硫剂:550℃时,将H2S和还原性气体H2按一定比例混合,以一定的流速通过装有锌的复合金属脱硫剂(ZnFe2O4)的反应器,脱硫过程中,ZnFe2O4与H2S、H2反应生成了ZnS、FeS和H2O,其化学方程式为
(3)生物脱硫技术。
天然气是一种重要的化工原料和燃料,常含有少量H2S。H2S与碱反应转化为HS‒,在脱氮硫杆菌参与下,HS‒被NO
 氧化为SO
氧化为SO 、NO
、NO 被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO
被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO 的物质的量为
的物质的量为
您最近一年使用:0次
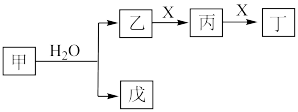
3 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了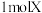 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: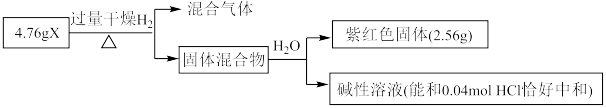
(5)X的化学式为
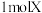 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次
解题方法
4 . 氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O①
2NO2+2NaOH=NaNO2+NaNO3+H2O②
在反应①中,氧化剂是___________ ,还原剂是___________ ,在反应②中,氧化剂和还原剂的物质的量之比为___________
(2)汽气车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为___________ 。
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)___________ ,原因是___________ 。
(4)目前有一种治理方法是在一定条件下用氨气将氮氧化物转化为无污染的物质,请写出氨气与二氧化氮反应的化学方程式:___________ ;该反应中,氧化剂是___________ ,氧化产物是___________ ,生成1.4mol氮气时,转移电子的物质的量为___________ 。
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3L,通入3L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为___________ 。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O①
2NO2+2NaOH=NaNO2+NaNO3+H2O②
在反应①中,氧化剂是
(2)汽气车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)
(4)目前有一种治理方法是在一定条件下用氨气将氮氧化物转化为无污染的物质,请写出氨气与二氧化氮反应的化学方程式:
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3L,通入3L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为
您最近一年使用:0次
解题方法
5 . 按要求,回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,反应的离子方程式是___________ 。
(2)氯气可用湿润的淀粉碘化钾试纸检验,请用化学方程式解释原因:___________ 。
(3)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是___________ 。
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是___________。
(5)某同学在探究漂白粉溶液性质时,在漂白粉溶液中加入几滴无色酚酞溶液,发现溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈___________ 性,并具有___________ 性。
(6)实验室也可用 固体和浓盐酸反应制氯气,反应方程式如下:
固体和浓盐酸反应制氯气,反应方程式如下: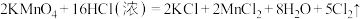 ,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
,若反应中有0.5mol电子转移,被氧化HCl的物质的量为___________ 。
(1)实验室用二氧化锰和浓盐酸反应制取氯气,反应的离子方程式是
(2)氯气可用湿润的淀粉碘化钾试纸检验,请用化学方程式解释原因:
(3)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是___________。
| A.食醋 | B.食盐 | C.烧碱 | D.纯碱 |
(6)实验室也可用
 固体和浓盐酸反应制氯气,反应方程式如下:
固体和浓盐酸反应制氯气,反应方程式如下: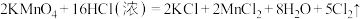 ,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
您最近一年使用:0次
6 . Ⅰ.下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其中加碘盐是氯化钠中添加适量的 ,其他成分未列出)
,其他成分未列出)
(1)请你对表中①~⑦的主要成分进行分类,是电解质的是______ ,是非电解质的是______ 。(填序号)
(2)写出④在水中的电离方程式____________ 。
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:______________ 。
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为
(4)反应中氧化剂与还原剂的个数之比为______ ,其中 反应中显出来的性质是
反应中显出来的性质是______ 。
(5)该反应中的氧化产物为______ ,每生成11.2L(标准状况下)的NO,转移的电子个数为______ 。
 ,其他成分未列出)
,其他成分未列出)名称 | 天然气 | 白酒 | 醋酸 | 小苏打 |
主要成分 | ① | ② | ③ | ④ |
名称 | 熟石灰 | 铜线 | 加碘盐 | |
主要成分 | ⑤ | ⑥Cu | ⑦NaCl和 |
(2)写出④在水中的电离方程式
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为

(4)反应中氧化剂与还原剂的个数之比为
 反应中显出来的性质是
反应中显出来的性质是(5)该反应中的氧化产物为
您最近一年使用:0次
名校
7 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近一年使用:0次
8 . 处理工业废气中的 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中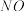 和
和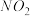 去除率的有
去除率的有_______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
②吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是_______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: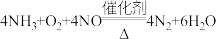 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为_______ 。
(3)氧化吸收法。
① 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
② 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式:_______ ; 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是_______ 。
 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中
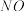 和
和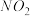 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液②吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为(3)氧化吸收法。
①
 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②
 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式: 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是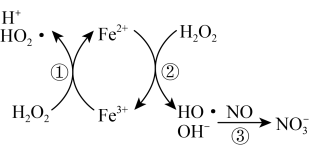
您最近一年使用:0次
9 . 取2molFeS与2L一定浓度的硝酸反应,生成了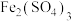 、
、 、NO、
、NO、 、
、 和
和 。反应后的溶液中
。反应后的溶液中 ,生成的NO、
,生成的NO、 和
和 的物质的量之比为1:1:1(溶液体积变化忽略不计),请回答:
的物质的量之比为1:1:1(溶液体积变化忽略不计),请回答:
(1)反应后溶液中 的浓度为
的浓度为______ 。
(2)参加反应的FeS与 的物质的量之比为
的物质的量之比为______ 。
(3)原硝酸的浓度为______ 。
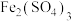 、
、 、NO、
、NO、 、
、 和
和 。反应后的溶液中
。反应后的溶液中 ,生成的NO、
,生成的NO、 和
和 的物质的量之比为1:1:1(溶液体积变化忽略不计),请回答:
的物质的量之比为1:1:1(溶液体积变化忽略不计),请回答:(1)反应后溶液中
 的浓度为
的浓度为(2)参加反应的FeS与
 的物质的量之比为
的物质的量之比为(3)原硝酸的浓度为
您最近一年使用:0次
10 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为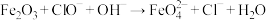 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: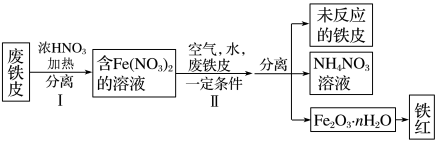
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为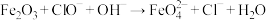 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近一年使用:0次
2024-05-03更新
|
128次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高一下学期期中考试化学试题








