1 . 亚硝酸钠(NaNO2)为白色粉末,易溶于水,味微咸,有毒;广泛应用于工业建筑领域,允许限量做食品添加剂,用于防腐和肉制品增色。某化学小组对亚硝酸钠的性质和用途进行了如下探究。
(1)NaNO2中N元素的化合价为__ ,据此推断NaNO2__ (填字母)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作___________ (填“氧化剂”或“还原剂”)。
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入___________ (填“FeSO4溶液、KSCN溶液”或“酸性KMnO4溶液”),观察到的实验现象为___________ ,据此得出预测结论。
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3 2NaNO2+O2↑。
2NaNO2+O2↑。
途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式___________ 。
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为___________ 。
(1)NaNO2中N元素的化合价为
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3
 2NaNO2+O2↑。
2NaNO2+O2↑。途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 铁是最常见的金属之一、纳米铁粉可用于处理酸性含氮废水(主要含 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成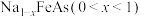 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是
 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成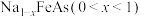 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是| A.NaFeAs与水反应所得溶液pH下降 | B.消耗1 mol NaFeAs,转移2 mol电子 |
| C.NaFeAs与水反应时体现还原性 | D.制备NaFeAs无须隔绝空气和水 |
您最近一年使用:0次
2024-04-13更新
|
68次组卷
|
2卷引用:江苏省盐城市大丰高级中学2023-2024学年高一下学期(创新班)第一次阶段性考试化学试卷
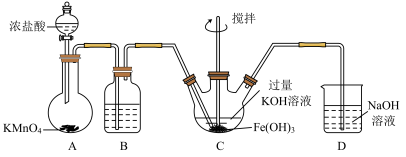
3 . 实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应: 制取并收集纯净、干燥的氯气,装置如图所示:
制取并收集纯净、干燥的氯气,装置如图所示:
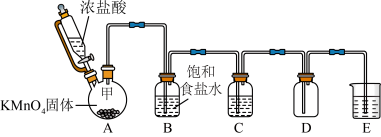
(1)①装置A中甲仪器的名称是_______ 。
②装置B的作用是_______ 。
③装置C中盛装的药品是_______ 。
④装置E中发生反应的化学方程是_______ 。
(2) 。若产生
。若产生 ,则转移的电子数目为
,则转移的电子数目为_______ ,浓盐酸体现了_______ 性质(选填字母编号)。
A.酸性 B.碱性 C.氧化性 D.还原性
(3)在该反应中,被还原的元素是_______ ,氧化剂与还原剂的物质的量之比为_______ 。
 制取并收集纯净、干燥的氯气,装置如图所示:
制取并收集纯净、干燥的氯气,装置如图所示:
(1)①装置A中甲仪器的名称是
②装置B的作用是
③装置C中盛装的药品是
④装置E中发生反应的化学方程是
(2)
 。若产生
。若产生 ,则转移的电子数目为
,则转移的电子数目为A.酸性 B.碱性 C.氧化性 D.还原性
(3)在该反应中,被还原的元素是
您最近一年使用:0次
23-24高一上·北京海淀·期中
名校
4 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: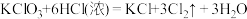 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
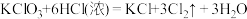 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
名校
解题方法
5 . 研究SO2的性质对SO2的污染防治与利用意义重大。
Ⅰ.SO2性质探究
(1)从物质分类角度看,SO2属于酸性氧化物。写出用足量氨水吸收SO2的化学方程式:______ 。
(2)从元素价态看,SO2中S元素为+4价,既具有氧化性又具有还原性。为探究SO2的还原性,设计如图所示的装置,将SO2通入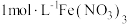 和BaCl2混合溶液中,观察到有白色沉淀生成。
和BaCl2混合溶液中,观察到有白色沉淀生成。 ,
, 与Ba2+反应生成白色沉淀。
与Ba2+反应生成白色沉淀。 与Fe3+反应放热的离子方程式为
与Fe3+反应放热的离子方程式为_____ 。
②乙同学认为甲同学的分析有失偏颇,其理由是______ 。
Ⅱ.SO2综合利用
(3)工业上常用足量的Na2CO3溶液吸收工业尾气中的SO2,将其转化为一种正盐,同时生成一种酸式盐,写出反应的化学方程式:______ 。
(4)一定条件下,SO2与H2O可发生催化反应: 。该工艺中若消耗3molSO2,转移的电子为
。该工艺中若消耗3molSO2,转移的电子为______ mol。
Ⅲ.空气质量测定
(5)SO2气体会引起酸雨,酸雨是pH小于______ 的雨水。
(6)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。用注射器缓缓推入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,该空气中二氧化硫的体积分数为______ (用含V的代数式表示,已知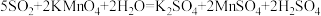 )。
)。
Ⅰ.SO2性质探究
(1)从物质分类角度看,SO2属于酸性氧化物。写出用足量氨水吸收SO2的化学方程式:
(2)从元素价态看,SO2中S元素为+4价,既具有氧化性又具有还原性。为探究SO2的还原性,设计如图所示的装置,将SO2通入
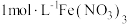 和BaCl2混合溶液中,观察到有白色沉淀生成。
和BaCl2混合溶液中,观察到有白色沉淀生成。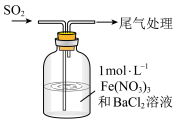
 ,
, 与Ba2+反应生成白色沉淀。
与Ba2+反应生成白色沉淀。 与Fe3+反应放热的离子方程式为
与Fe3+反应放热的离子方程式为②乙同学认为甲同学的分析有失偏颇,其理由是
Ⅱ.SO2综合利用
(3)工业上常用足量的Na2CO3溶液吸收工业尾气中的SO2,将其转化为一种正盐,同时生成一种酸式盐,写出反应的化学方程式:
(4)一定条件下,SO2与H2O可发生催化反应:
 。该工艺中若消耗3molSO2,转移的电子为
。该工艺中若消耗3molSO2,转移的电子为Ⅲ.空气质量测定
(5)SO2气体会引起酸雨,酸雨是pH小于
(6)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。用注射器缓缓推入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,该空气中二氧化硫的体积分数为
 )。
)。
您最近一年使用:0次
2023-05-04更新
|
398次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高一下学期4月月考测试化学试卷
名校
6 . 二氧化氯( )具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过
)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过 与酸性
与酸性 溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备
溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备 并探究其性质。
并探究其性质。
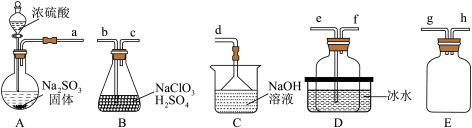
已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 。回答下列问题:
。回答下列问题:
(1)A中盛装浓 的仪器名称是
的仪器名称是_______ 。
(2)通过装置B中反应制备 ,其化学反应方程式为
,其化学反应方程式为_______ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a→g→h→
,选择上图中的装置,其接口的连接顺序为a→g→h→_______ 。
(4)装置D盛放冰水的目的是_______ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为_______ g。(计算结果保留一位小数)
 )具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过
)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过 与酸性
与酸性 溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备
溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备 并探究其性质。
并探究其性质。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 。回答下列问题:
。回答下列问题:(1)A中盛装浓
 的仪器名称是
的仪器名称是(2)通过装置B中反应制备
 ,其化学反应方程式为
,其化学反应方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a→g→h→
,选择上图中的装置,其接口的连接顺序为a→g→h→(4)装置D盛放冰水的目的是
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2022-12-22更新
|
90次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三上学期1月月考化学试题
名校
7 . 高铁酸钾( ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
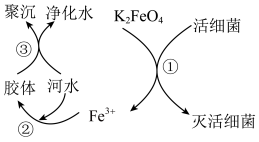
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)过程①中活性菌表现了______ (填“氧化”或“还原”)性,过程③属于______ (填“物理”或“化学”)变化。
(2)根据上述原理分析,作水处理剂时, 的作用有
的作用有______ (填两个)。
(3)制备高铁酸钾常用的反应原理为 (反应未配平)。
(反应未配平)。
配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:______ ,
将该反应改写为离子方程式:______ 。
(4)已知反应:
①
②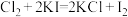
③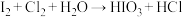 (未配平)
(未配平)
反应①中若有 参与反应,转移的电子数目为
参与反应,转移的电子数目为______ ,对于反应①②③下列说法正确的是______ (填字母)。
A.反应①中氧化剂和还原剂的物质的量之比为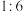
B.结合反应②③,若将 通入含有淀粉的
通入含有淀粉的 溶液中,可能会观察到先变蓝后褪色
溶液中,可能会观察到先变蓝后褪色
C.还原性由强到弱顺序:
D.氧化性由强到弱顺序: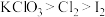
(5)在硫酸溶液中, 和
和 能按粒子个数比
能按粒子个数比 完全反应,生成一种棕黄色气体X,同时
完全反应,生成一种棕黄色气体X,同时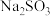 被氧化为
被氧化为 ,则X为______(填字母)。
,则X为______(填字母)。
 ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)过程①中活性菌表现了
(2)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(3)制备高铁酸钾常用的反应原理为
 (反应未配平)。
(反应未配平)。配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:
将该反应改写为离子方程式:
(4)已知反应:
①

②
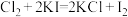
③
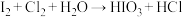 (未配平)
(未配平)反应①中若有
 参与反应,转移的电子数目为
参与反应,转移的电子数目为A.反应①中氧化剂和还原剂的物质的量之比为
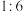
B.结合反应②③,若将
 通入含有淀粉的
通入含有淀粉的 溶液中,可能会观察到先变蓝后褪色
溶液中,可能会观察到先变蓝后褪色C.还原性由强到弱顺序:

D.氧化性由强到弱顺序:
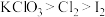
(5)在硫酸溶液中,
 和
和 能按粒子个数比
能按粒子个数比 完全反应,生成一种棕黄色气体X,同时
完全反应,生成一种棕黄色气体X,同时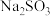 被氧化为
被氧化为 ,则X为______(填字母)。
,则X为______(填字母)。A.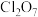 | B. | C. | D. |
您最近一年使用:0次
2023-12-27更新
|
112次组卷
|
2卷引用:山东省菏泽市曹县第一中学2023-2024学年高一上学期 月考化学试题
8 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。
资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价_____ 。
(2)装置B中的试剂为_____ ,作用_____ 。
(3)装置C中制备K2FeO4时,发生反应的化学方程式为_____ ,每得到1mol K2FeO4,理论上消耗Cl2的物质的量为_____ mol。
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为_____ ,高铁酸钾作为水处理剂起到的作用是_____ 。
(5)制备 K2FeO4可以采用干式氧化法,初始反应为
 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为_____ 。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价
(2)装置B中的试剂为
(3)装置C中制备K2FeO4时,发生反应的化学方程式为
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为
(5)制备 K2FeO4可以采用干式氧化法,初始反应为

 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为
您最近一年使用:0次
名校
9 . “环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式___________ 。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:___________ 。
②过程Ⅱ为硝化过程,在微生物的作用下实现 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→ →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为___________ 。
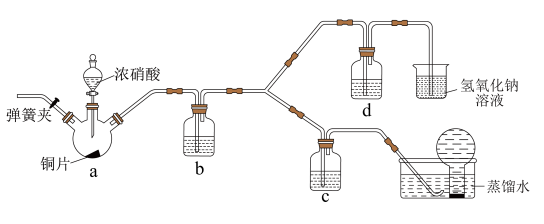
(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是___________ 、___________ 、___________ 。其中装置a中发生反应的化学方程式是___________ 。
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
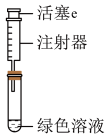
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,___________ (填“操作”和“现象”),证实装置a中溶解了NO2。___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以
 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下: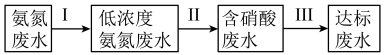
②过程Ⅱ为硝化过程,在微生物的作用下实现
 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→
 →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,
您最近一年使用:0次
10 . 二氧化氯(ClO2)是国际公认的广谱、高效和安全的杀菌剂。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:________ 。
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是____ ,氧化产物是_____ 。
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为________ 。
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的_____ 倍(保留2位小数)。
(5)若以NaClO2为原料制备ClO2,需要加入具有____ (填“氧化性”或“还原性”)的物质。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的
(5)若以NaClO2为原料制备ClO2,需要加入具有
您最近一年使用:0次



