解题方法
1 .  是一种氧化剂,可以用来制取氯气。
是一种氧化剂,可以用来制取氯气。
(1)高锰酸钾溶于水的电离方程式为_______ 。它属于_______ (选填“强电解质”、“弱电解质”、“非电解质”);
(2)已知高锰酸钾固体在室温下能将浓盐酸氧化,发生反应: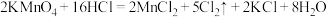
①标明上述化学方程式电子转移方向和数目_______ 。
②在该反应中,被还原的元素是_______ ,浓盐酸体现了_______ 性质(选填字母编号),氧化剂与还原剂的物质的量之比为_______ 。
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
③产生 ,则转移的电子数目为
,则转移的电子数目为_______ 。
④下列装置中,可用作该反应的气体发生装置的是(选填字母编号)_______ 。
A.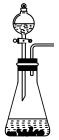 B.
B. 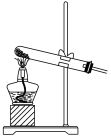 C.
C. 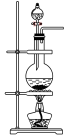
⑤用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放_______ ,装置E中可盛放_______ (均选填字母编号)
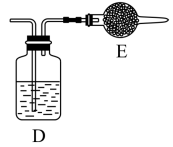
A. 浓硫酸 B. NaOH溶液 C. 饱和食盐水 D. 固体 E. 碱石灰
E. 碱石灰
⑥氯气可用排空气法收集,装置G中盛放为NaOH溶液,作用是_______ ,并写出反应的离子方程式_______ 。
(3)实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:
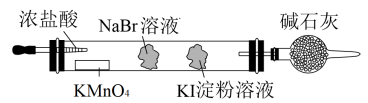
该装置中,吸有KI淀粉溶液的棉球颜色变为_______ 。吸有NaBr溶液的棉球中发生反应的离子方程式为_______ 。由反应现象能否得出活泼性 的结论?回答并说明理由
的结论?回答并说明理由_______ 。
(4)COVID-19在全球的蔓延,对人类的健康和全球的经济带来了很大的影响,为了控制疫情,全球进行了大面积的消杀工作,消毒液发挥了重要的作用,请回答下列有关消毒液的问题。
①生产消毒液是将氯气通入NaOH溶液中,取少量该消毒液滴加酸性 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有_______ (填离子符号)。
②消毒液稀释后喷洒在空气中,可以生成有漂白性的物质和碳酸氢钠,请写出此过程的化学方程式:_______ ;该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学方程式:_______ 。
 是一种氧化剂,可以用来制取氯气。
是一种氧化剂,可以用来制取氯气。(1)高锰酸钾溶于水的电离方程式为
(2)已知高锰酸钾固体在室温下能将浓盐酸氧化,发生反应:
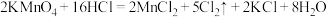
①标明上述化学方程式电子转移方向和数目
②在该反应中,被还原的元素是
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
③产生
 ,则转移的电子数目为
,则转移的电子数目为④下列装置中,可用作该反应的气体发生装置的是(选填字母编号)
A.
 B.
B.  C.
C. 
⑤用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放

A. 浓硫酸 B. NaOH溶液 C. 饱和食盐水 D. 固体
 E. 碱石灰
E. 碱石灰⑥氯气可用排空气法收集,装置G中盛放为NaOH溶液,作用是

(3)实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:

该装置中,吸有KI淀粉溶液的棉球颜色变为
 的结论?回答并说明理由
的结论?回答并说明理由(4)COVID-19在全球的蔓延,对人类的健康和全球的经济带来了很大的影响,为了控制疫情,全球进行了大面积的消杀工作,消毒液发挥了重要的作用,请回答下列有关消毒液的问题。
①生产消毒液是将氯气通入NaOH溶液中,取少量该消毒液滴加酸性
 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有②消毒液稀释后喷洒在空气中,可以生成有漂白性的物质和碳酸氢钠,请写出此过程的化学方程式:
您最近半年使用:0次
2 . 亚硝酸钠(NaNO2)为白色粉末,易溶于水,味微咸,有毒;广泛应用于工业建筑领域,允许限量做食品添加剂,用于防腐和肉制品增色。某化学小组对亚硝酸钠的性质和用途进行了如下探究。
(1)NaNO2中N元素的化合价为__ ,据此推断NaNO2__ (填字母)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作___________ (填“氧化剂”或“还原剂”)。
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入___________ (填“FeSO4溶液、KSCN溶液”或“酸性KMnO4溶液”),观察到的实验现象为___________ ,据此得出预测结论。
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3 2NaNO2+O2↑。
2NaNO2+O2↑。
途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式___________ 。
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为___________ 。
(1)NaNO2中N元素的化合价为
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3
 2NaNO2+O2↑。
2NaNO2+O2↑。途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为
您最近半年使用:0次
解题方法
3 . 84消毒液是一种常见的含氯消海剂。如图为某品牌84消毒液的说明书中的部分内容。
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式______________ 。
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
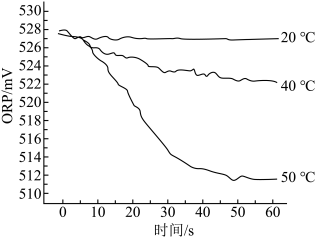
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______________________ 。
②实验Ⅲ不同温度时ORP值不同的原因可能是____________________ 。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式_________________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应: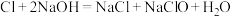 ;
;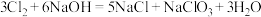 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为___________ 。
| 产品特点: 本品是以次氯钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项: 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 |
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验Ⅲ不同温度时ORP值不同的原因可能是
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应:
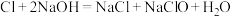 ;
;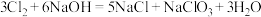 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
您最近半年使用:0次
名校
4 . 高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂,资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
①除杂装B中的试剂为___________ 。
②C为制备K2FeO4装置,过量KOH溶液的作用是___________ 。
③D为尾气处理装置,发生反应的离子方程式为___________ 。
(2)探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有___________ 。该离子的产生___________ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而生成的,理由是___________ 。
②方案Ⅱ得出氧化性:Cl2___________  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质K2FeO4在硫酸溶液中反应如下: +___________
+___________
①完成上述离子方程式___________ 。
②现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数约为___________ (计算结果保留到0.1%)。
(1)制备K2FeO4

①除杂装B中的试剂为
②C为制备K2FeO4装置,过量KOH溶液的作用是
③D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,然后将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
②方案Ⅱ得出氧化性:Cl2
 (填“>”或“<”)
(填“>”或“<”)(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质K2FeO4在硫酸溶液中反应如下:
 +___________
+___________①完成上述离子方程式
②现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数约为
您最近半年使用:0次
名校
解题方法
5 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
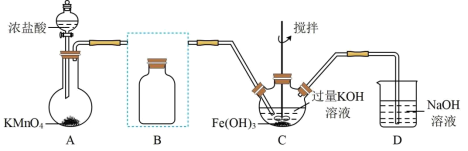
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
解题方法
6 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________ 。该反应中氧化产物是_____________ (填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________ 。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____ (填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________ (填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近半年使用:0次
名校
解题方法
7 . 已知反应:2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)请用双线桥法表示该反应___________ 。
(2)该反应的离子方程式是___________ 。
(3)浓盐酸在上述反应中显示出来的性质是___________(填序号)。
(4)该反应的氧化剂是___________ ,氧化产物是___________ ,氧化剂与还原剂的个数之比是___________ 。
(5)若生成 1 个 Cl2,则转移的电子数为___________ 。
(1)请用双线桥法表示该反应
(2)该反应的离子方程式是
(3)浓盐酸在上述反应中显示出来的性质是___________(填序号)。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(5)若生成 1 个 Cl2,则转移的电子数为
您最近半年使用:0次
名校
解题方法
8 . 铁是最常见的金属之一、纳米铁粉可用于处理酸性含氮废水(主要含 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成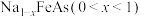 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是
 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成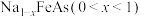 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是| A.NaFeAs与水反应所得溶液pH下降 | B.消耗1 mol NaFeAs,转移2 mol电子 |
| C.NaFeAs与水反应时体现还原性 | D.制备NaFeAs无须隔绝空气和水 |
您最近半年使用:0次
2024-04-13更新
|
65次组卷
|
2卷引用:江苏省盐城市大丰高级中学2023-2024学年高一下学期(创新班)第一次阶段性考试化学试卷
9 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近半年使用:0次
10 . 实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以在常温下利用反应: 制取并收集纯净、干燥的氯气,装置如图所示:
制取并收集纯净、干燥的氯气,装置如图所示:
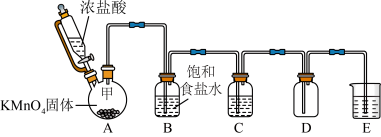
(1)①装置A中甲仪器的名称是_______ 。
②装置B的作用是_______ 。
③装置C中盛装的药品是_______ 。
④装置E中发生反应的化学方程是_______ 。
(2) 。若产生
。若产生 ,则转移的电子数目为
,则转移的电子数目为_______ ,浓盐酸体现了_______ 性质(选填字母编号)。
A.酸性 B.碱性 C.氧化性 D.还原性
(3)在该反应中,被还原的元素是_______ ,氧化剂与还原剂的物质的量之比为_______ 。
 制取并收集纯净、干燥的氯气,装置如图所示:
制取并收集纯净、干燥的氯气,装置如图所示:
(1)①装置A中甲仪器的名称是
②装置B的作用是
③装置C中盛装的药品是
④装置E中发生反应的化学方程是
(2)
 。若产生
。若产生 ,则转移的电子数目为
,则转移的电子数目为A.酸性 B.碱性 C.氧化性 D.还原性
(3)在该反应中,被还原的元素是
您最近半年使用:0次



