2013·山东滨州·一模
解题方法
1 . (1)某学习小组利用下图装置制取氯气并探究其性质。
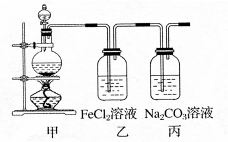
①甲装置中反应的化学方程式是_____________________________________ ;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)__________________________________________________________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是____________________________________ 。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含________________ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):

①甲装置中反应的化学方程式是
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| ② | ||
您最近半年使用:0次
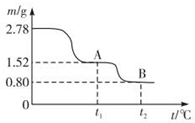
2 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
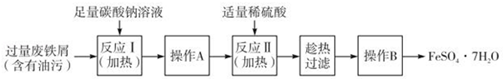
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近半年使用:0次
名校
解题方法
3 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如图所示:
2CrCl3(s)+3COCl2(g),其实验装置如图所示:
②碱性条件下,H2O2可将Cr3+氧化为CrO ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+
还原为Cr3+
回答下列问题:
(1)基态Cr原子的简化核外电子排布式为______ 。
(2)无水CaCl2的作用是______ 。
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是______ ;可通过______ (填操作)使实验继续进行。
(4)装置G中发生反应生成两种盐的化学方程式为______ 。
(5)测定产品中CrCl3质量分数的实验步骤如下:
I.取5gCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使CrO 转化为Cr2O
转化为Cr2O ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;
Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.0mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL(已知Cr2O 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①该样品中CrCl3的质量分数为______ %(保留小数点后两位)
②下列操作将导致产品中CrCl3质量分数测定值偏低的是______ (填标号)。
A.步骤I中未继续加热一段时间
B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤Ⅱ中未加浓磷酸
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 2CrCl3(s)+3COCl2(g),其实验装置如图所示:
2CrCl3(s)+3COCl2(g),其实验装置如图所示: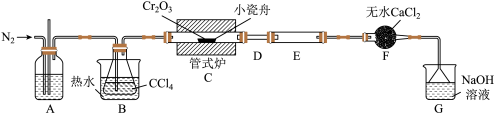
②碱性条件下,H2O2可将Cr3+氧化为CrO
 ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+
还原为Cr3+回答下列问题:
(1)基态Cr原子的简化核外电子排布式为
(2)无水CaCl2的作用是
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是
(4)装置G中发生反应生成两种盐的化学方程式为
(5)测定产品中CrCl3质量分数的实验步骤如下:
I.取5gCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使CrO
 转化为Cr2O
转化为Cr2O ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.0mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL(已知Cr2O
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①该样品中CrCl3的质量分数为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤I中未继续加热一段时间
B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤Ⅱ中未加浓磷酸
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近半年使用:0次
2023-05-18更新
|
159次组卷
|
2卷引用:湖南省新高考教学教研联盟(长郡十八校联盟)2022-2023学年高二下学期5月联考化学试题
4 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中的CO2和H2O而变质。某课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计如图装置来测定过氧化钠的质量分数。
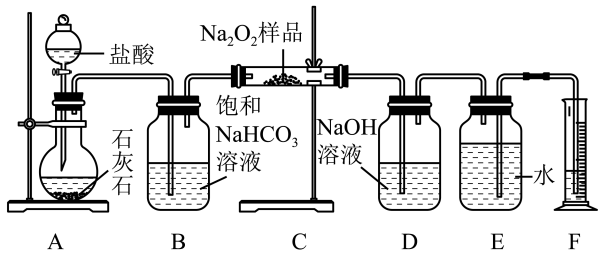
(1)将仪器连接好以后,第一步必须进行的操作是___________ 。
(2)写出装置C中发生反应的化学方程式:___________ 、___________ 。
(3)装置D中NaOH溶液的作用是___________ 。
(4)测量收集到的气体体积时必须包括三个步骤:
①使装置内的气体冷却至室温;
②___________ ;
③读取量筒中水的体积。
(5)装置C中Na2O2充分反应,读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中Na2O2的质量分数为___________ 。
(6)Na2O2可用来制备一种应用前景非常好的高效、多功能水处理剂Na2FeO4。化学方程式为 ,对此反应下列说法中正确的是___________(填字母)。
,对此反应下列说法中正确的是___________(填字母)。

(1)将仪器连接好以后,第一步必须进行的操作是
(2)写出装置C中发生反应的化学方程式:
(3)装置D中NaOH溶液的作用是
(4)测量收集到的气体体积时必须包括三个步骤:
①使装置内的气体冷却至室温;
②
③读取量筒中水的体积。
(5)装置C中Na2O2充分反应,读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中Na2O2的质量分数为
(6)Na2O2可用来制备一种应用前景非常好的高效、多功能水处理剂Na2FeO4。化学方程式为
 ,对此反应下列说法中正确的是___________(填字母)。
,对此反应下列说法中正确的是___________(填字母)。| A.Na2O2只作氧化剂 | B.O2是还原产物 |
| C.Na2FeO4既是氧化产物又是还原产物 | D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
您最近半年使用:0次
名校
5 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠经常因为保存不当容易吸收空气中CO2而变质。
I.某课外小组欲用如图装置探究过氧化钠与CO2反应后的产物。已知:碳酸氢钠受热易分解。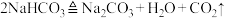 ,试回答下列问题:
,试回答下列问题:

(1)B装置的作用是________ 。
(2)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转弯为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式:____ ,该反应中氧化剂和还原剂的质量比为_______ ;若2分子CO2通过C装置后恰好完全反应,这过程转移____ 个电子。
II.该课外小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
III.超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式_______ 。
I.某课外小组欲用如图装置探究过氧化钠与CO2反应后的产物。已知:碳酸氢钠受热易分解。
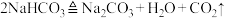 ,试回答下列问题:
,试回答下列问题:
(1)B装置的作用是
(2)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转弯为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式:
II.该课外小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
III.超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式
您最近半年使用:0次
名校
6 . 某化工厂出厂的漂白粉说明书如下:
(1)漂白粉的有效成分为___________ ,工业上制取漂白粉的化学方程式为___________ 。
(2)将漂白粉溶于水配成480 mL溶液,要使 浓度为0.1 mol/L,则需称量漂白粉质量为
浓度为0.1 mol/L,则需称量漂白粉质量为___________ g。(保留一位小数)
(3)配制上述溶液玻璃仪器除了要使用烧杯、玻璃棒、胶头滴管外还需要使用的仪器有___________ 。
(4)在配制过程中,下列实验操作对所配制的 溶液的物质的量浓度有何影响(填“偏大”“偏小”或“无影响”)?
溶液的物质的量浓度有何影响(填“偏大”“偏小”或“无影响”)?
a.定容时俯视容量瓶刻度线:___________ 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:___________ 。
(5)将含有少量HCl的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),温度较高时氯气与消石灰反应: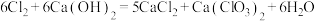 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是___________ ;
①如图为反应后溶液中 、
、 离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。

a.图中曲线Ⅰ表示___________ 离子的物质的量随反应时间变化的关系。
b.所用石灰乳中含有 的物质的量为
的物质的量为___________ mol。
c.另取一份含有等物质的量 的石灰乳,以较大的速率通入足量氯气,反应后测得产物中
的石灰乳,以较大的速率通入足量氯气,反应后测得产物中 的物质的量为0.39 mol,则产物中
的物质的量为0.39 mol,则产物中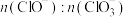
___________ 。
②试判断另一个副反应是___________ (写出此反应的化学方程式)。
| 使用说明 【主要成份】次氯酸钙、氯化钙(次氯酸钙的质量分数为35%) 【用途用量】取漂白粉2至3g,水1000g,配成溶液,将病人用具浸泡其中5至10分钟。 如需要,浓度可提高,时间可延长。 【注意事项】密封避光保存于阴凉处,随配随用,有腐蚀性,少与手接触。 |
(1)漂白粉的有效成分为
(2)将漂白粉溶于水配成480 mL溶液,要使
 浓度为0.1 mol/L,则需称量漂白粉质量为
浓度为0.1 mol/L,则需称量漂白粉质量为(3)配制上述溶液玻璃仪器除了要使用烧杯、玻璃棒、胶头滴管外还需要使用的仪器有
(4)在配制过程中,下列实验操作对所配制的
 溶液的物质的量浓度有何影响(填“偏大”“偏小”或“无影响”)?
溶液的物质的量浓度有何影响(填“偏大”“偏小”或“无影响”)?a.定容时俯视容量瓶刻度线:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(5)将含有少量HCl的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),温度较高时氯气与消石灰反应:
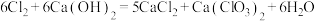 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是①如图为反应后溶液中
 、
、 离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
离子的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气和水的反应)。
a.图中曲线Ⅰ表示
b.所用石灰乳中含有
 的物质的量为
的物质的量为c.另取一份含有等物质的量
 的石灰乳,以较大的速率通入足量氯气,反应后测得产物中
的石灰乳,以较大的速率通入足量氯气,反应后测得产物中 的物质的量为0.39 mol,则产物中
的物质的量为0.39 mol,则产物中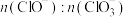
②试判断另一个副反应是
您最近半年使用:0次
名校
解题方法
7 . 某化工厂用氯气与氢氧化钙生产漂白粉。回答以下问题:
(1)漂白粉的有效成分是_______ (填化学式)。
(2)生产漂白粉原理是(用化学方程式表示)_______ 。
(3)“密封避光保存于阴凉处,随用随配”是因为漂白粉有效成份与空气中CO2、H2O反应生成不稳定的次氯酸而易失效,该反应的化学方程式为_______ 。
(4)一种制备高效氧化型漂白剂NaClO2的实验流程如图所示
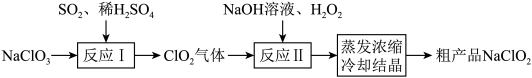
①反应Ⅰ的化学方程式为: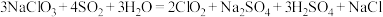 ;反应Ⅰ中氧化产物和还原产物物质的量比为
;反应Ⅰ中氧化产物和还原产物物质的量比为_______ ,反应Ⅱ中H2O2做_______ (填“氧化剂”或“还原剂”)
②写出NaClO2的电离方程式:_______ ;该漂白剂与HClO的漂白原理_______ 相同(填“是”或“否”)
(1)漂白粉的有效成分是
(2)生产漂白粉原理是(用化学方程式表示)
(3)“密封避光保存于阴凉处,随用随配”是因为漂白粉有效成份与空气中CO2、H2O反应生成不稳定的次氯酸而易失效,该反应的化学方程式为
(4)一种制备高效氧化型漂白剂NaClO2的实验流程如图所示

①反应Ⅰ的化学方程式为:
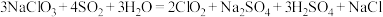 ;反应Ⅰ中氧化产物和还原产物物质的量比为
;反应Ⅰ中氧化产物和还原产物物质的量比为②写出NaClO2的电离方程式:
您最近半年使用:0次
名校
8 . 某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、CuO。某工厂利用此矿石回收单质铜和绿矾(FeSO4·7H2O)。工艺流程如图,根据流程回答下列问题:
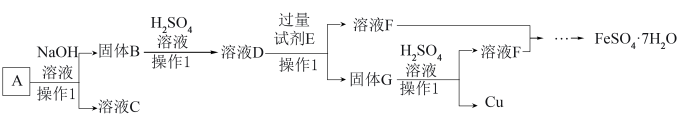
(1)操作1的名称是______ 。
(2)溶液C的溶质主要是______ 。
(3)检验溶液D中含Fe3+的方法是______ ,溶液D与过量试剂E反应的离子方程式Fe+Cu2+=Fe2++Cu、______ 。
(4)FeSO4·7H2O可处理工业废水中有毒的 ,反应的离子方程式为Fe2++
,反应的离子方程式为Fe2++ +H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为
+H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为______ 。
(5)FeSO4·7H2O由于保存不当容易被空气中氧气氧化而变质,可用酸性KMnO4溶液测定其纯度,测定原理为5Fe2++ +8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
+8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为______ (用含有a、c、V的式子表示)。

(1)操作1的名称是
(2)溶液C的溶质主要是
(3)检验溶液D中含Fe3+的方法是
(4)FeSO4·7H2O可处理工业废水中有毒的
 ,反应的离子方程式为Fe2++
,反应的离子方程式为Fe2++ +H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为
+H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为(5)FeSO4·7H2O由于保存不当容易被空气中氧气氧化而变质,可用酸性KMnO4溶液测定其纯度,测定原理为5Fe2++
 +8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
+8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
您最近半年使用:0次
22-23高一下·四川·期中
名校
9 . 以黄铁矿(主要成分为FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。
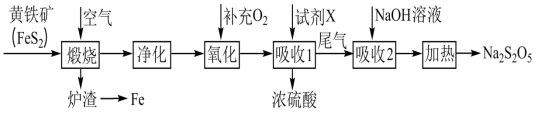
(1)FeS2中铁元素的化合价为___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收SO3时宜选用的试剂X为___________ 。
(4)因为Na2S2O5在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品Na2S2O5中不可避免地存在Na2SO4.欲检验是否变质,可取少量样品溶于水中,___________ ,说明含有 。
。
(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:___________ 。
________S2O +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+
(6)某同学以如图所示装置用电化学原理模拟生产硫酸:

①电极a为原电池的________ (填“正”或“负”)极。写出通入O2的电极的电极反应式________ 。
②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为_____ ;溶液中的H+_____ (填“从左向右”或“从右向左”)移动。

(1)FeS2中铁元素的化合价为
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收SO3时宜选用的试剂X为
(4)因为Na2S2O5在保存过程中发生
 。
。(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:
________S2O
 +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+(6)某同学以如图所示装置用电化学原理模拟生产硫酸:

①电极a为原电池的
②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为
您最近半年使用:0次
10 . 高铁酸钾 (K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与 反应制备
反应制备
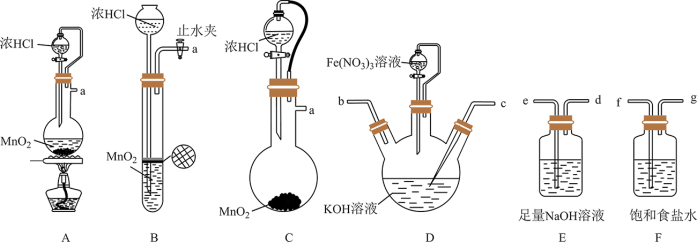
(1)氯气的发生装置可以选择图中的_______ (用图中大写字母表示);化学反应方程式为_______ 。
(2)选择上述装置,制备 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。_________
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下:
在硫酸溶液中反应如下:
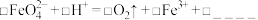
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。__________
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。
Ⅱ.干法制备高铁酸钾的主要反应为: 。
。
(4)①该反应中的还原剂是_______ 。
②每生成 转移
转移_______ 个电子(阿伏加德罗常数用 表示)。
表示)。
(5)简要说明 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用_______ 。
 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与
 反应制备
反应制备

(1)氯气的发生装置可以选择图中的
(2)选择上述装置,制备
 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下:
在硫酸溶液中反应如下: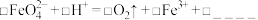
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
Ⅱ.干法制备高铁酸钾的主要反应为:
 。
。(4)①该反应中的还原剂是
②每生成
 转移
转移 表示)。
表示)。(5)简要说明
 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用
您最近半年使用:0次



