名校
解题方法
1 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加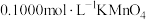 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗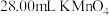 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: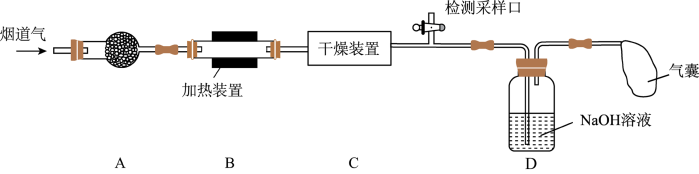
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: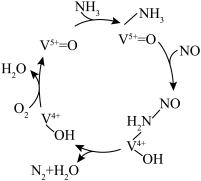
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: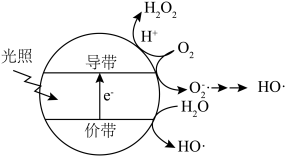
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加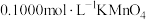 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗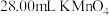 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近半年使用:0次
2024-05-03更新
|
186次组卷
|
3卷引用:03 2024年苏州昆山中学高一3月月考
名校
2 . 为测定Cu和Cu2O混合粉末中Cu的含量。某同学将44.8g Cu和Cu2O混合粉末加入500mL 4.5mol/L的稀硝酸中,得到6.72LNO(标准状况下),忽略溶液体积的变化。下列说法正确的是
| A.反应后有固体剩余 | B.混合粉末中Cu的质量分数约为37% |
| C.反应后的溶液中c(Cu2+)=1.2mol/L | D.在反应后的溶液中加入足量铁粉,可置换出41.6g Cu |
您最近半年使用:0次
3 . 微量元素体检报告单显示,某儿童体内铁元素含量偏低。
(1)硫酸亚铁晶体( )在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
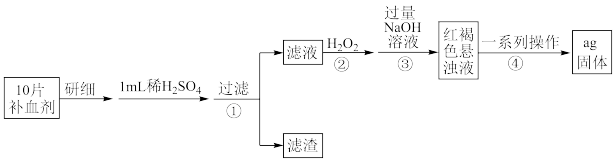
请回答下列问题:
①取步骤①的滤液滴加 溶液后变为红色,说明滤液中含有
溶液后变为红色,说明滤液中含有 ,写出反应的离子方程式
,写出反应的离子方程式_____ ,加入 粉后红色褪去,写出加入铁粉时反应的离子方程式:
粉后红色褪去,写出加入铁粉时反应的离子方程式:_____ 。
②步骤②加入过量 的目的是
的目的是_____ 。
③假设实验中的损耗忽略不计,若1片补血剂的质量为bg,则补血剂中铁元素的质量分数为_____ 。
(2)纳米级的 是一种非常重要的磁性材料。
是一种非常重要的磁性材料。
① 溶于稀盐酸的离子方程式为
溶于稀盐酸的离子方程式为_____ 。
②铁在氧气中燃烧生成 ,反应中每生成1
,反应中每生成1
 转移
转移_____  电子。
电子。
(1)硫酸亚铁晶体(
 )在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
①取步骤①的滤液滴加
 溶液后变为红色,说明滤液中含有
溶液后变为红色,说明滤液中含有 ,写出反应的离子方程式
,写出反应的离子方程式 粉后红色褪去,写出加入铁粉时反应的离子方程式:
粉后红色褪去,写出加入铁粉时反应的离子方程式:②步骤②加入过量
 的目的是
的目的是③假设实验中的损耗忽略不计,若1片补血剂的质量为bg,则补血剂中铁元素的质量分数为
(2)纳米级的
 是一种非常重要的磁性材料。
是一种非常重要的磁性材料。①
 溶于稀盐酸的离子方程式为
溶于稀盐酸的离子方程式为②铁在氧气中燃烧生成
 ,反应中每生成1
,反应中每生成1
 转移
转移 电子。
电子。
您最近半年使用:0次
解题方法
4 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: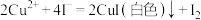 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: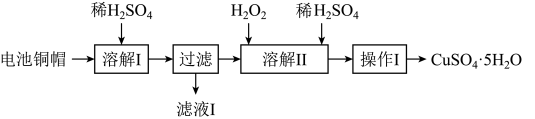
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
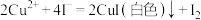 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近半年使用:0次
5 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
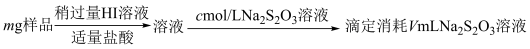
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
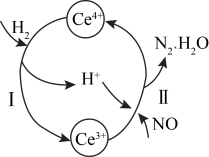
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近半年使用:0次
名校
6 . 以硅藻土为载体的五氧化二钒(V2O3)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O3既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
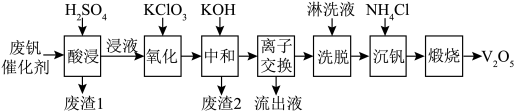
回答下列问题:
(1)“酸浸”时V2O5转化为 , 反应的离子方程式为
, 反应的离子方程式为___________ ,同时V2O4转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是______ 。
(2)“氧化”中使 变为
变为 , 则“氧化”环节中还原剂与氧化剂的物质的量之比为
, 则“氧化”环节中还原剂与氧化剂的物质的量之比为______ 。
(3)“中和”后的溶液中,钒主要以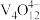 形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+
形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+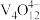
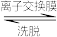
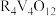 +
+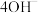 (以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈
(以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈_____ 性(填“敢”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为___ 。
(5)“煅烧”中发生反应的化学方程式 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(1)“酸浸”时V2O5转化为
 , 反应的离子方程式为
, 反应的离子方程式为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 , 则“氧化”环节中还原剂与氧化剂的物质的量之比为
, 则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“中和”后的溶液中,钒主要以
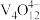 形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+
形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+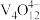
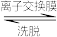
 +
+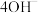 (以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈
(以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式
您最近半年使用:0次
名校
7 . 某同学为测定 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是
 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是| A.反应后有固体剩余 | B.反应后的溶液中 |
C. 单质在混合粉末中的质量分数约为 单质在混合粉末中的质量分数约为 | D.在反应后的溶液中加入足量铁粉,可畳换出 |
您最近半年使用:0次
2024-04-28更新
|
104次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一下学期4月月考化学试题
名校
8 . 工业上,处理低晶位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O),相关流程如图。
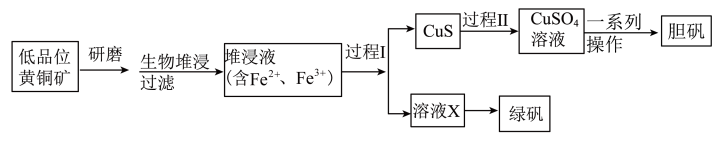
(1)基态Cu2+核外电子的空间运动状态有_______ 种。
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为_______ 。
(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择_______ (填序号)。
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有_______ (已知: 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。
(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是_______ (填“氧化剂”或“还原剂”)。
(5)制备胆矾的“一系列操作”包含_______ 、过滤、洗涤、干燥。
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为_______ ,此时,消耗KMnO4溶液的体积为VmL,则绿矾晶体质量分数的计算式为_______ 。(FeSO4·7H2O摩尔质量为278g/mol)

(1)基态Cu2+核外电子的空间运动状态有
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2
 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有
 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是
(5)制备胆矾的“一系列操作”包含
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为
您最近半年使用:0次
名校
9 . I、现有一份含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。(可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水。)回答下列问题:
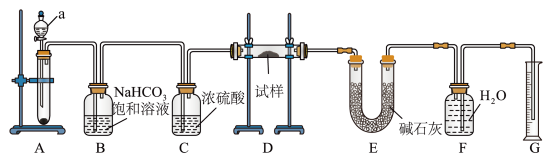
(1)装置a的名称为_______ 。
(2)装置B的作用:_______ 。
(3)装置D中生成O2的反应的化学方程式为_______ 。
(4)装置E中的碱石灰的主要作用是_______ ;若撤掉装置E,会使测得的Na2O2的含量_______ (选填“偏高”,“偏低”,“无影响”)。
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数_______ 。
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为_______ 。
A.先通CO2再通NH3 B.先通NH3再通CO2

(1)装置a的名称为
(2)装置B的作用:
(3)装置D中生成O2的反应的化学方程式为
(4)装置E中的碱石灰的主要作用是
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.先通CO2再通NH3 B.先通NH3再通CO2
您最近半年使用:0次
名校
解题方法
10 . 漂白粉的效能是以有效氯的含量来衡量的。有效氯是指漂白粉与浓盐酸生成氯气的质量与漂白粉的质量之比。
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度________ (用小数表示,保留小数点后1位)。
(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少________ (用百分数表示)?
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。________
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为
 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。
您最近半年使用:0次



