名校
1 . 为测定Cu和Cu2O混合粉末中Cu的含量。某同学将44.8g Cu和Cu2O混合粉末加入500mL 4.5mol/L的稀硝酸中,得到6.72LNO(标准状况下),忽略溶液体积的变化。下列说法正确的是
| A.反应后有固体剩余 | B.混合粉末中Cu的质量分数约为37% |
| C.反应后的溶液中c(Cu2+)=1.2mol/L | D.在反应后的溶液中加入足量铁粉,可置换出41.6g Cu |
您最近一年使用:0次
解题方法
2 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是___ 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为___ 。
(3)吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是___ (填序号)。
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是___ 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知: )
)
①达到滴定终点时的现象为___ 。
②该样品中NaClO2的质量分数为___ (用含m、c、V的代数式表示,结果化成最简)

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是
a.将SO2氧化成SO3,增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为
(3)吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:
 )
)①达到滴定终点时的现象为
②该样品中NaClO2的质量分数为
您最近一年使用:0次
2016-12-09更新
|
586次组卷
|
2卷引用:安徽省安庆市宿松县2023-2024学年高三第一次模拟预测化学试题
解题方法
3 . 在800℃下, 和焦炭反应可生成
和焦炭反应可生成 和
和 ,同时得到
,同时得到 或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随
或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随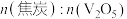 的变化关系如图所示。下列说法中错误的是
的变化关系如图所示。下列说法中错误的是
 和焦炭反应可生成
和焦炭反应可生成 和
和 ,同时得到
,同时得到 或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随
或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随 的变化关系如图所示。下列说法中错误的是
的变化关系如图所示。下列说法中错误的是
A.焦炭用量越大,反应后体系中 的质量分数越小 的质量分数越小 |
B. 的氧化性比 的氧化性比 和 和 强 强 |
C.若氧化产物有CO和 ,产物中 ,产物中 ,则参加反应的 ,则参加反应的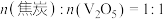 |
D.若氧化产物只有 ,参加反应的 ,参加反应的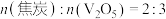 时,反应所得 时,反应所得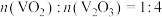 |
您最近一年使用:0次
2023-11-14更新
|
34次组卷
|
2卷引用:安徽省芜湖市无为市华星学校2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
4 . 某反应过程中存在Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子,测得Fe3+、a的质量分数(ω)随时间变化的曲线如图所示,下列判断正确的是
、H+和H2O六种粒子,测得Fe3+、a的质量分数(ω)随时间变化的曲线如图所示,下列判断正确的是
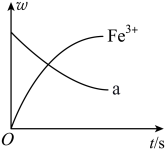
 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子,测得Fe3+、a的质量分数(ω)随时间变化的曲线如图所示,下列判断正确的是
、H+和H2O六种粒子,测得Fe3+、a的质量分数(ω)随时间变化的曲线如图所示,下列判断正确的是
A.a代表NH |
| B.反应后溶液pH值基本不变 |
| C.还原剂与氧化剂的物质的量之比为1:8 |
| D.根据信息可知Fe(NO3)2溶液不宜加酸酸化 |
您最近一年使用:0次
名校
解题方法
5 . 120℃时将1.6g由CO2、H2O组成的混合气体通入盛有足量Na2O2的密闭容器中,充分反应后容器中残留的固体比反应前增重0.64 g。下列说法错误的是
| A.反应过程中生成O2的质量为0.96 g |
| B.反应过程中被还原的元素的质量为0.96 g |
| C.该混合气体中CO2的质量分数为45% |
| D.反应过程中Na2O2既是氧化剂又是还原剂 |
您最近一年使用:0次
2023-11-28更新
|
218次组卷
|
3卷引用:安徽省淮南第二中学、淮南第一中学2023-2024学年高一上学期11月期中考试化学试题
名校
6 . 稀土是一种重要的战略资源,我国稀土出口量世界第一、饰(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:

回答下列问题:
(1)已知 中C为+4价,在空气中焙烧
中C为+4价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被___________ (填“氧化”或“还原”),该反应中氧化剂与还原剂物质的量之比为___________ 。
(2)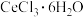 属于
属于___________ (填“纯净物”或“混合物”)。
(3)酸浸过程中用稀硫酸和 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:______ 。
(4)室温下,纳米级 分散到水中形成分散系。当
分散到水中形成分散系。当___________ (填实验操作、现象)时,该分散系为胶体。
(5)准确称取 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: )该样品中
)该样品中 的质量分数为
的质量分数为___________ 。(结果保留三位有效数字)
 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:
回答下列问题:
(1)已知
 中C为+4价,在空气中焙烧
中C为+4价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被(2)
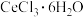 属于
属于(3)酸浸过程中用稀硫酸和
 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:(4)室温下,纳米级
 分散到水中形成分散系。当
分散到水中形成分散系。当(5)准确称取
 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: )该样品中
)该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-07-16更新
|
253次组卷
|
3卷引用:安徽省安庆市2022-2023学年高一上学期期末考试化学试题
安徽省安庆市2022-2023学年高一上学期期末考试化学试题四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
7 . 中科院成都研究所研究员李东提出了一种新的负排放技术——POWER TO GAS(可再生电转生物天然气)。这项技术,指的是先捕获工厂和沼气池产生的二氧化碳,利用可再生电水解制氢,再将氢气用于还原沼气中的二氧化碳,使二氧化碳变为甲烷( ),替代天然气使用。设
),替代天然气使用。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 ),替代天然气使用。设
),替代天然气使用。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.25℃, , ,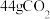 含有 含有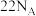 个电子 个电子 |
B. 质量分数为64%的 质量分数为64%的 水溶液中含有的氧原子数目为: 水溶液中含有的氧原子数目为: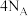 |
C.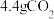 转变为 转变为 转移的电子数为 转移的电子数为 |
D.标准状况下, 中所含有的水分子数目为 中所含有的水分子数目为 |
您最近一年使用:0次
8 . 硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶[含 、
、 等杂质]的提纯流程如图。(已知:硝酸锶、硝酸钡不溶于浓硝酸)
等杂质]的提纯流程如图。(已知:硝酸锶、硝酸钡不溶于浓硝酸)

(1)该流程中,要加快“酸浸”速率一般不采取升温这个措施,请用化学方程式解释原因_______ 。
(2)操作 的名称是
的名称是_______ ,洗涤所用的洗涤剂是_______ 。
(3)硝酸锶的水溶液呈性_______ , 的结构式为
的结构式为_______ 。
(4)“滤液 ”中过量的
”中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式
,同时放出无污染的气体,写出发生反应的离子方程式_______ ;氧化产物与还原产物的物质的量之比为_______ 。
(5)已知 不溶于水,还原后调节
不溶于水,还原后调节 的目的是
的目的是_______ 。
(6)为了测定“残渣 ”中
”中 元素的质量分数,进行以下实验。(已知:
元素的质量分数,进行以下实验。(已知: )
)

若加入的 溶液过量太多,测定结果会是
溶液过量太多,测定结果会是_______  填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响” ,请用离子方程式分析其可能的原因
,请用离子方程式分析其可能的原因_______ 。 写一个即可
写一个即可
 、
、 等杂质]的提纯流程如图。(已知:硝酸锶、硝酸钡不溶于浓硝酸)
等杂质]的提纯流程如图。(已知:硝酸锶、硝酸钡不溶于浓硝酸)
(1)该流程中,要加快“酸浸”速率一般不采取升温这个措施,请用化学方程式解释原因
(2)操作
 的名称是
的名称是(3)硝酸锶的水溶液呈性
 的结构式为
的结构式为(4)“滤液
 ”中过量的
”中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式
,同时放出无污染的气体,写出发生反应的离子方程式(5)已知
 不溶于水,还原后调节
不溶于水,还原后调节 的目的是
的目的是(6)为了测定“残渣
 ”中
”中 元素的质量分数,进行以下实验。(已知:
元素的质量分数,进行以下实验。(已知: )
)
若加入的
 溶液过量太多,测定结果会是
溶液过量太多,测定结果会是 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响” ,请用离子方程式分析其可能的原因
,请用离子方程式分析其可能的原因 写一个即可
写一个即可
您最近一年使用:0次
解题方法
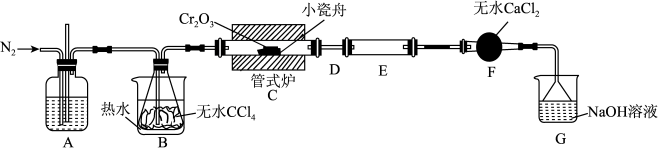
9 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: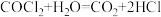 ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
(1)A装置用于干燥 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是_______ ;无水 的作用是
的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)尾气与装置G中过量的 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是_______ 。
(4)测定产品中 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:
Ⅰ.取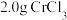 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量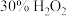 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液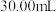 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。
①计算产品中 质量分数为
质量分数为_______ 。
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是_______ (填字母标号)。
A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中 溶液部分变质
溶液部分变质
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:①
 (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: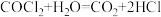 ;
;②碱性条件下,
 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。(1)A装置用于干燥
 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是 的作用是
的作用是(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是
(3)尾气与装置G中过量的
 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是(4)测定产品中
 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:Ⅰ.取
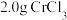 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量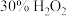 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使
 转化为
转化为 。
。Ⅲ.在溶液中加入适量浓
 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗 标准溶液
标准溶液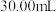 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。①计算产品中
 质量分数为
质量分数为②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中
 溶液部分变质
溶液部分变质D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2022-03-29更新
|
663次组卷
|
3卷引用:安徽省皖南八校2022-2023学年高三上学期第一次大联考化学试题
名校
10 . 水体中氨氮含量会造成水体富营养化,用次氯酸钠除去氨氮的原理如图所示。下列说法错误的是


| A.去除过程中,每一步反应都是氧化还原反应 |
| B.每除去2个NH3,转移6个电子 |
| C.该过程需控制温度,温度过高时氨氮去除率会降低 |
| D.去除过程的总反应方程式为:2NH3+3NaClO=N2+3NaCl+3H2O |
您最近一年使用:0次
2023-10-05更新
|
40次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2022-2023学年高一上学期11月月考化学试题



