解题方法
1 . 工业上常通过石煤灰渣(主要成分有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 )回收钒的氧化物,有关工艺流程如图:
)回收钒的氧化物,有关工艺流程如图:
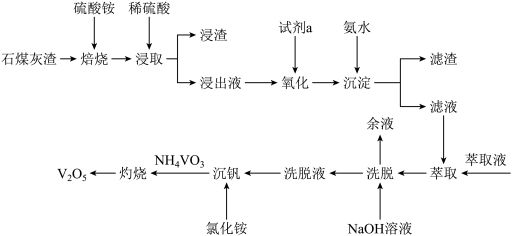
已知:①“焙烧”时,在空气的作用下, 被氧化为
被氧化为 。
。
② 在稀硫酸作用下生成
在稀硫酸作用下生成 。
。
③已知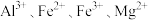 开始生成沉淀和沉淀完全的
开始生成沉淀和沉淀完全的 如表:
如表:
根据所学知识回答下列问题:
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是_______ 。
(2) 中V的化合价为
中V的化合价为_______ ,“浸渣”的主要成分除了 ,还有
,还有_______ (填化学式)。
(3)“氧化”时加入的试剂a常用 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。 也能氧化
也能氧化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是_______ 。
(4)“沉淀”时,控制溶液 在4.5~6.5之间,“滤渣”的主要成分是
在4.5~6.5之间,“滤渣”的主要成分是_______ (填化学式)。
(5)在500℃灼烧脱氨可制得产品 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。在硫酸酸化条件下, 可与草酸(H2C2O4)溶液反应得到含
可与草酸(H2C2O4)溶液反应得到含 的溶液,写出发生反应的离子方程式:
的溶液,写出发生反应的离子方程式:_______ 。
(6) 某批次的石煤灰渣中
某批次的石煤灰渣中 的含量为
的含量为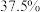 工业生产中钒的漫出率为
工业生产中钒的漫出率为 ,若后续步骤中钒损耗为
,若后续步骤中钒损耗为 ,则理论上制得的
,则理论上制得的 的质量最多为
的质量最多为_______ t(保留三位有效数字)。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 )回收钒的氧化物,有关工艺流程如图:
)回收钒的氧化物,有关工艺流程如图:
已知:①“焙烧”时,在空气的作用下,
 被氧化为
被氧化为 。
。②
 在稀硫酸作用下生成
在稀硫酸作用下生成 。
。③已知
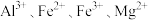 开始生成沉淀和沉淀完全的
开始生成沉淀和沉淀完全的 如表:
如表:| 离子 |  |  |  |  |
开始沉淀 | 2.8 | 8.1 | 1.2 | 9.0 |
完全沉淀 | 4.5 | 9.6 | 3.2 | 11.1 |
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是
(2)
 中V的化合价为
中V的化合价为 ,还有
,还有(3)“氧化”时加入的试剂a常用
 ,写出反应的离子方程式
,写出反应的离子方程式 也能氧化
也能氧化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是(4)“沉淀”时,控制溶液
 在4.5~6.5之间,“滤渣”的主要成分是
在4.5~6.5之间,“滤渣”的主要成分是(5)在500℃灼烧脱氨可制得产品
 ,写出该反应的化学方程式:
,写出该反应的化学方程式: 可与草酸(H2C2O4)溶液反应得到含
可与草酸(H2C2O4)溶液反应得到含 的溶液,写出发生反应的离子方程式:
的溶液,写出发生反应的离子方程式:(6)
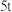 某批次的石煤灰渣中
某批次的石煤灰渣中 的含量为
的含量为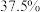 工业生产中钒的漫出率为
工业生产中钒的漫出率为 ,若后续步骤中钒损耗为
,若后续步骤中钒损耗为 ,则理论上制得的
,则理论上制得的 的质量最多为
的质量最多为
您最近一年使用:0次
名校
解题方法
2 . 将1.52g铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(换算为标准状况体积),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
| A.该合金中铜与镁的物质的量之比是1:2 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,N2O4的体积分数是20% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
您最近一年使用:0次
2020-11-28更新
|
327次组卷
|
5卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题
青海湟川中学2020-2021学年高一下学期3月考化学试题江西省鹰潭市2019-2020年度高一下学期期末检测化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2022年高考化学考点微专题安徽省六安市第一中学2021-2022学年高二上学期开学考试化学试题安徽师范大学附属中学2022-2023学年高二上学期开学考试化学试题
解题方法
3 . 已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);
②被还原的HNO3的物质的量。
您最近一年使用:0次
2020-01-29更新
|
148次组卷
|
3卷引用:青海省西宁市海湖中学2020-2021学年高一上学期第二次阶段考试化学试题
4 . 在实验室中,可以有如下两种方法制备二氧化氯(ClO2),回答下列问题
Ⅰ.
Ⅱ.
(1)NaClO3中Cl的化合价为______________ 。
(2)Ⅰ中还原产物是______________ 。
(3)Ⅱ的离子方程式为__________________________________________ ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为_____________ L。
(4)二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(得失电子数)相当于多少克C12的氧化能力(Cl均转化为Cl-)。ClO2的有效氯含量为_________________ (计算结果保留两位小数)
Ⅰ.

Ⅱ.

(1)NaClO3中Cl的化合价为
(2)Ⅰ中还原产物是
(3)Ⅱ的离子方程式为
(4)二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(得失电子数)相当于多少克C12的氧化能力(Cl均转化为Cl-)。ClO2的有效氯含量为
您最近一年使用:0次



