1 . Ⅰ.钠是典型的金属元素,钠的化合物具有广泛的用途。请回答以下问题:
(1)15.6g 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中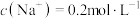 ,则X的摩尔质量为
,则X的摩尔质量为______ 。
(2) 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: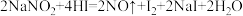 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为______ 。标况下,每生成11.2L的NO气体,转移的电子数约为______ 个。
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClO
Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为______ 。
(5)流程中可循环利用的物质为______ (填化学式)。
(6)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为______ (用百分数表示,保留到小数点后1位)。
(1)15.6g
 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中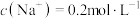 ,则X的摩尔质量为
,则X的摩尔质量为(2)
 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: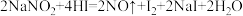 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClOⅡ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为
(5)流程中可循环利用的物质为
(6)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为
您最近一年使用:0次
名校
解题方法
2 . 硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为__________ 。
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为___________ (填化学式)。
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2。该反应的化学方程式为____________________ 。
(2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为____________ 。
②处理后的废水中Cr3+的物质的量浓度为__________ mol·L-1。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2。该反应的化学方程式为
(2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为
②处理后的废水中Cr3+的物质的量浓度为
您最近一年使用:0次
2017-06-04更新
|
136次组卷
|
2卷引用:河北省邢台市2016-2017学年高二下学期第三次月考化学试题
名校
3 . 纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是___________ 。
②该白色沉淀置于空气中能观察的现象是___________ 。
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
用离子方程式解释FeOOH生成后溶液pH下降的原因:___________ 。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是___________ 。
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
以上结果表明:___________ 。
③a=7和a=9时,FeOOH产率差异很大的原因是___________ 。
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___________ 。
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:
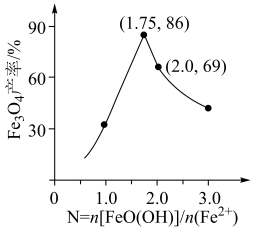
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___________ 。
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为___________ 。
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是
②该白色沉淀置于空气中能观察的现象是
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
| a | 7.0 | 8.0 | 9.0 |
| FeO(OH)的产率 | <50% | 95% | >95% |
| FeO(OH)生成后的pH | 接近4 | 接近4 | 接近4 |
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
| c(Fe2+)/mol/L | FeO(OH)百分含量/% | Fe2O3百分含量/% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
③a=7和a=9时,FeOOH产率差异很大的原因是
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为
您最近一年使用:0次
名校
解题方法
4 . 研究实验发现硝酸的浓度越稀,硝酸发生氧化还原反应时,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入 溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示,下列说法不正确的是
溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示,下列说法不正确的是

 溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示,下列说法不正确的是
溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示,下列说法不正确的是
| A.该稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.c点对应NaOH溶液的体积为40mL |
| C.b点与a点的差值为0.05mol |
| D.样品中铝粉和铁粉的物质的量之比为3:5 |
您最近一年使用:0次
名校
5 . 化学知识与生产生活息息相关。
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是__________ (写化学式),用于制造光导纤维的材料是__________ (写化学式)。光导纤维在碱性土壤中易被腐蚀,请写出相关的离子反应方程式______________________
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成分是__________________ (写化学式);漂白粉保存不当易变质,请写出漂白粉失效的方程式________________ ;如不小心把漂白粉与洁厕灵(主要成分为盐酸)混合,易生成氯气使人中毒。请写出有关反应的离子方程式________________________ 。
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示_____________ 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________ mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=______________ 。
III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是_____________ ;
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是_______________
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是_____________
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成分是
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示
②所取石灰乳中含有Ca(OH)2的物质的量为
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=

III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
您最近一年使用:0次
6 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
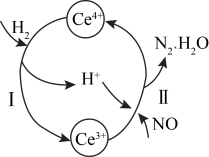
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 富马酸亚铁(结构简式为 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:

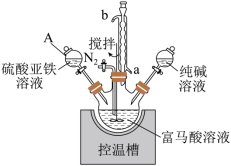
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入
您最近一年使用:0次
名校
8 . 氯化铬( )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(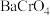 )可制备少量氯化铬:
)可制备少量氯化铬:

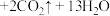 。回答下列问题:
。回答下列问题:
(1)上述反应中,还原剂是_________ ,还原产物与氧化产物的物质的量之比是________ 。
(2)该制备操作方法中,需加稍过量的乙醇,目的是________ 。
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.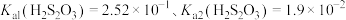 。
。
Ⅱ.上述过程发生反应: 、
、 。
。
① 标准液应盛放在
标准液应盛放在_______ 中进行滴定。
②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是_______ 。
③滴定时,平行测定3次,平均消耗 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是______ (保留四位有效数字)。
 )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(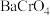 )可制备少量氯化铬:
)可制备少量氯化铬:

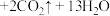 。回答下列问题:
。回答下列问题:(1)上述反应中,还原剂是
(2)该制备操作方法中,需加稍过量的乙醇,目的是
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.
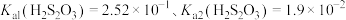 。
。Ⅱ.上述过程发生反应:
 、
、 。
。①
 标准液应盛放在
标准液应盛放在②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是
③滴定时,平行测定3次,平均消耗
 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是
您最近一年使用:0次
解题方法
9 .  是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
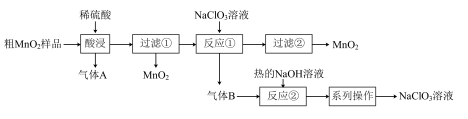
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
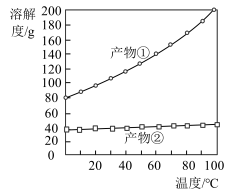
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
(4)若粗 样品的质量为
样品的质量为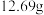 ,经“过滤①”得到
,经“过滤①”得到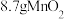 ,并收集到
,并收集到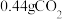 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为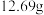 ,经“过滤①”得到
,经“过滤①”得到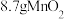 ,并收集到
,并收集到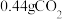 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近一年使用:0次
10 . (NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;
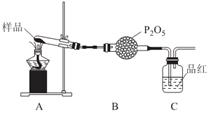
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
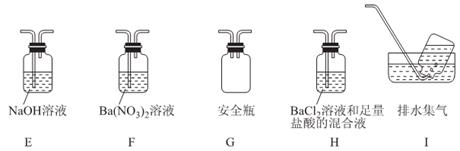
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

您最近一年使用:0次



