名校
解题方法
1 . 如图是某元素形成物质的“价—类”图,图中显示各物质之间的转化关系。其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D的大16,回答下列问题:
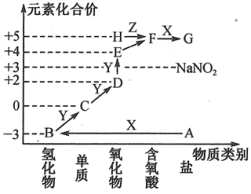
(1)写出下列物质的化学式:C.____ ;H_____ 。
(2)实验室制取B的化学方程式为_____ ,可用____ 试纸检验B是否集满。在B的催化氧化反应中,氧化剂与还原剂的物质的量之比为_____ 。
(3) 都是大气污染物,在有催化剂加热的条件下二者可反应生成无污染的物质,写出该反应的化学方程式:
都是大气污染物,在有催化剂加热的条件下二者可反应生成无污染的物质,写出该反应的化学方程式:____ 。
(4)写出 溶液与F的稀溶液反应的离子方程式:
溶液与F的稀溶液反应的离子方程式:_____ 。
(5)已知 在空气中会氧化变质(部分转化为G),取部分变质后的固体样品
在空气中会氧化变质(部分转化为G),取部分变质后的固体样品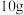 与
与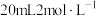 的酸性
的酸性 溶液恰好完全反应(
溶液恰好完全反应( 全部转化为
全部转化为 ),则样品中
),则样品中 的纯度为
的纯度为___ 。

(1)写出下列物质的化学式:C.
(2)实验室制取B的化学方程式为
(3)
 都是大气污染物,在有催化剂加热的条件下二者可反应生成无污染的物质,写出该反应的化学方程式:
都是大气污染物,在有催化剂加热的条件下二者可反应生成无污染的物质,写出该反应的化学方程式:(4)写出
 溶液与F的稀溶液反应的离子方程式:
溶液与F的稀溶液反应的离子方程式:(5)已知
 在空气中会氧化变质(部分转化为G),取部分变质后的固体样品
在空气中会氧化变质(部分转化为G),取部分变质后的固体样品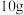 与
与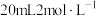 的酸性
的酸性 溶液恰好完全反应(
溶液恰好完全反应( 全部转化为
全部转化为 ),则样品中
),则样品中 的纯度为
的纯度为
您最近一年使用:0次
2022-05-04更新
|
135次组卷
|
2卷引用:辽宁省凌源市三校2021-2022学年高一下学期4月检测化学试题
名校
解题方法
2 . 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法不正确的是
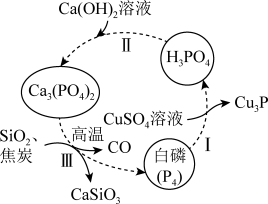

| A.过程Ⅰ中,氧化产物与还原产物的物质的量之比为6∶5 |
B. 的空间结构为正四面体形 的空间结构为正四面体形 |
| C.过程Ⅰ、Ⅱ、Ⅲ中发生的均为氧化还原反应 |
| D.流程中所涉及元素的基态原子未成对电子数最多的是P |
您最近一年使用:0次
2022-05-20更新
|
645次组卷
|
7卷引用:辽宁省大连市2021-2022学年高三第二次模拟考试化学试题
解题方法
3 . 部分被氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如图处理:

下列说法错误的是

下列说法错误的是
| A.滤液A中的阳离子为Fe2+和H+ |
| B.样品中氧元素的质量是0.48g |
| C.溶解样品的过程中消耗硫酸的总物质的量为0.04mol |
| D.V=336 |
您最近一年使用:0次
4 . 硫代硫酸钠(Na2S2O3·5H2O)的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含Na2S和Na2CO3的溶液中通入SO2来制备Na2S2O3(其简单流程如图所示)。

①写出制备Na2S2O3的化学方程式:____ 。
②“一系列操作”包括____ 、____ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用Na2S2O3溶液吸收尾气中的Cl2,氧化产物为SO 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:____ 。
(3)临床上,Na2S2O3可用于氰化物解毒,解毒原理:S2O +CN-=SCN-+SO
+CN-=SCN-+SO 。检验该转化生成了SCN-的操作为
。检验该转化生成了SCN-的操作为____ 。
(4)探究Na2S2O3和稀硫酸反应速率与浓度、温度关系的实验方案如表:
已知:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O。
变浑浊时间最短的实验是____ (填实验编号)。
(5)工业上,测定V2O5样品纯度的方法:取wg样品溶于稀硫酸,加入足量KI溶液,再加入cmol·L-1的Na2S2O3溶液至恰好完全反应,消耗Na2S2O3溶液VmL。
相关反应:V2O5+2KI+3H2SO4=2VOSO4+I2+K2SO4+3H2O;I2+2Na2S2O3=2NaI+Na2S4O6。
①该样品中V2O5的质量分数为____ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会____ (填“偏高”、“偏低”或“无影响”)。
(1)实验室可通过向含Na2S和Na2CO3的溶液中通入SO2来制备Na2S2O3(其简单流程如图所示)。

①写出制备Na2S2O3的化学方程式:
②“一系列操作”包括
(2)工业上,常用Na2S2O3溶液吸收尾气中的Cl2,氧化产物为SO
 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,Na2S2O3可用于氰化物解毒,解毒原理:S2O
 +CN-=SCN-+SO
+CN-=SCN-+SO 。检验该转化生成了SCN-的操作为
。检验该转化生成了SCN-的操作为(4)探究Na2S2O3和稀硫酸反应速率与浓度、温度关系的实验方案如表:
| 实验编号 | 0.1mol·L-1Na2S2O3溶液的体积/mL | 蒸馏水的体积/mL | 0.1mol·L-1稀硫酸的体积/mL | 温度/℃ | 变浑浊时间/s |
| ① | 10 | 0 | 10 | 25 | a |
| ② | 10 | 0 | 10 | 35 | b |
| ③ | 5 | 5 | 10 | 35 | c |
变浑浊时间最短的实验是
(5)工业上,测定V2O5样品纯度的方法:取wg样品溶于稀硫酸,加入足量KI溶液,再加入cmol·L-1的Na2S2O3溶液至恰好完全反应,消耗Na2S2O3溶液VmL。
相关反应:V2O5+2KI+3H2SO4=2VOSO4+I2+K2SO4+3H2O;I2+2Na2S2O3=2NaI+Na2S4O6。
①该样品中V2O5的质量分数为
②如果稀硫酸过多,测得结果会
您最近一年使用:0次
2022-05-03更新
|
414次组卷
|
4卷引用:辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题
名校
5 . 过氧化钙晶体(CaO2 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
轻质CaCO3粉末 滤液
滤液 白色结晶体
白色结晶体 目标产物
目标产物
回答下列问题:
(1)CaO2电子式:_________________ 。
(2)反应①的离子方程式为_________________ ;过滤过程中用到的玻璃仪器有_________ 。
(3)用上述方法制取CaO2 8H2O的化学方程式为
8H2O的化学方程式为___________________________________ 。
(4)操作②温度不宜过高,其可能原因是___________________________________________ 。
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2 +8H2O+K2SO4
+8H2O+K2SO4
,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为________ (用含a、b、c的代数式表示)。
 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。轻质CaCO3粉末
 滤液
滤液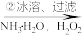 白色结晶体
白色结晶体 目标产物
目标产物回答下列问题:
(1)CaO2电子式:
(2)反应①的离子方程式为
(3)用上述方法制取CaO2
 8H2O的化学方程式为
8H2O的化学方程式为(4)操作②温度不宜过高,其可能原因是
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2
 +8H2O+K2SO4
+8H2O+K2SO4,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol
 L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
您最近一年使用:0次
解题方法
6 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
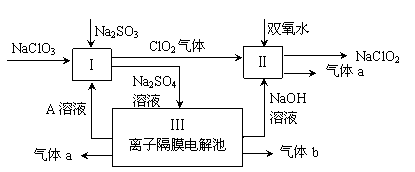
(1)双氧水的结构式为:___________ ;Ⅰ中发生反应的还原剂是_____ (填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________ 。
(3)A的化学式是________ ,装置Ⅲ中A在________ 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______ 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______ (填相同、不相同或无法判断)

(1)双氧水的结构式为:
(2)Ⅱ中反应的离子方程式是
(3)A的化学式是
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量
您最近一年使用:0次
解题方法
7 . 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.V=448 |
| C.样品中CuO的质量为2.0g | D.样品中Fe元素的质量为1.12 g |
您最近一年使用:0次



