名校
1 . (1)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现的性质是_______
A.酸性 B.氧化性 C.还原性 D.碱性
若反应生成标准状况下11.2 L NO,则被还原的HNO3为_______ mol,转移电子为_______ mol。
(2)已知NO不溶于水,NO2易溶于水,且与水发生反应3NO2+H2O=2HNO3+NO。把盛有48 mL NO和NO2混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24 mL,则:
①原混合气中,NO是_______ mL,NO2是_______ mL。
②若在剩余的24 mL气体中,通入6 mL O2,待液面稳定后,反应后容器内剩余气体体积为_______ mL。
③若在原48 mL NO、NO2中,通入_______ mLO2再倒置于水中,气体会全部被吸收。
A.酸性 B.氧化性 C.还原性 D.碱性
若反应生成标准状况下11.2 L NO,则被还原的HNO3为
(2)已知NO不溶于水,NO2易溶于水,且与水发生反应3NO2+H2O=2HNO3+NO。把盛有48 mL NO和NO2混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24 mL,则:
①原混合气中,NO是
②若在剩余的24 mL气体中,通入6 mL O2,待液面稳定后,反应后容器内剩余气体体积为
③若在原48 mL NO、NO2中,通入
您最近一年使用:0次
2021-05-06更新
|
629次组卷
|
2卷引用:武汉市江夏实验高中2020-2021学年高一下学期3月月考化学试题
2 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________ 。
②每生成1molFeO42-转移________ mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为_______________ (用含a、b的代数式表示)。
(3)已知:S2O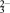 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________ 。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
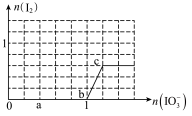
写出a点处还原产物是_______________ ;b点到c点反应的离子方程式________________
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO−、OH−、FeO42-、Cl−、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO42-转移
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I−===2Fe2++I2,2Fe2++Br2===2Fe3++2Br−,2Fe2++Cl2===2Fe3++2Cl−
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br−被氧化一半时,c为
(3)已知:S2O
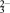 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I−+S4O62-,S2O82-+2I−→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。

写出a点处还原产物是
您最近一年使用:0次
2019-03-27更新
|
315次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高一下学期开学考试化学试题
名校
解题方法
3 . 肼(N2H4)是一种强还原剂,用 与
与 反应可用于生产肼(N2H4),其反应的化学方程式为:
反应可用于生产肼(N2H4),其反应的化学方程式为: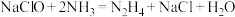 。工业碱性
。工业碱性 溶液中含有
溶液中含有 会影响所得肼的产品质量。测定碱性
会影响所得肼的产品质量。测定碱性 溶液中的
溶液中的 含量的方法如下:取
含量的方法如下:取 碱性
碱性 溶液试样,加入过量
溶液试样,加入过量 ,将
,将 完全还原
完全还原 (
( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的 ,冷却至室温,加入稀硫酸至酸性,再加入
,冷却至室温,加入稀硫酸至酸性,再加入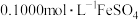 溶液
溶液 ,充分反应,将
,充分反应,将 完全还原
完全还原 ,再用
,再用 酸性
酸性 溶液氧化多余的
溶液氧化多余的 (
( 被还原为
被还原为 ),消耗酸性
),消耗酸性 溶液
溶液 。
。
(1) 与次氯酸钠反应的离子方程式为
与次氯酸钠反应的离子方程式为_______ 。
(2)通常不选用盐酸酸化 的原因是
的原因是_______ 。
(3)计算样品中 的含量(以g/L表示),写出计算过程。
的含量(以g/L表示),写出计算过程。_______ 。
 与
与 反应可用于生产肼(N2H4),其反应的化学方程式为:
反应可用于生产肼(N2H4),其反应的化学方程式为: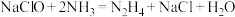 。工业碱性
。工业碱性 溶液中含有
溶液中含有 会影响所得肼的产品质量。测定碱性
会影响所得肼的产品质量。测定碱性 溶液中的
溶液中的 含量的方法如下:取
含量的方法如下:取 碱性
碱性 溶液试样,加入过量
溶液试样,加入过量 ,将
,将 完全还原
完全还原 (
( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的 ,冷却至室温,加入稀硫酸至酸性,再加入
,冷却至室温,加入稀硫酸至酸性,再加入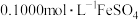 溶液
溶液 ,充分反应,将
,充分反应,将 完全还原
完全还原 ,再用
,再用 酸性
酸性 溶液氧化多余的
溶液氧化多余的 (
( 被还原为
被还原为 ),消耗酸性
),消耗酸性 溶液
溶液 。
。(1)
 与次氯酸钠反应的离子方程式为
与次氯酸钠反应的离子方程式为(2)通常不选用盐酸酸化
 的原因是
的原因是(3)计算样品中
 的含量(以g/L表示),写出计算过程。
的含量(以g/L表示),写出计算过程。
您最近一年使用:0次
名校
4 . (1)3.01×1023个OH-的物质的量为_______ ,含有电子的物质的量为_______ ,这些OH-和_______ g的Na+含有的电子数相同。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=_______ 。
(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式_______ 。
②浓盐酸在反应中显示出来的性质是_______ (填字母)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是_______ (填化学式),还原性Cl-______ Mn2+(填>、<或=)。
④用双线桥法表示该反应电子转移的方向和数目:_______ 。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、
 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式
②浓盐酸在反应中显示出来的性质是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是
④用双线桥法表示该反应电子转移的方向和数目:
您最近一年使用:0次
名校
解题方法
5 . 氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)该反应中氧化剂为______ ;氧化剂与还原剂的物质的量之比为______ 。
(2)浓盐酸在反应中表现出来的性质是________________ (填写编号)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)当此反应中产生标准状况下11.2 L的Cl2,则该反应转移的电子的数目为_____ ,参加反应的氯化氢的物质的量为______ mol。
(1)该反应中氧化剂为
(2)浓盐酸在反应中表现出来的性质是
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)当此反应中产生标准状况下11.2 L的Cl2,则该反应转移的电子的数目为
您最近一年使用:0次
2021-02-24更新
|
241次组卷
|
2卷引用:湖南省常德市淮阳中学2020-2021学年高一上学期期末考试化学试题
6 . Cu能与稀硝酸反应生成无色气体NO,其变化可表述为:___ Cu+______HNO3(稀)==______Cu(NO3)2+______NO↑+______H2O
(1)请配平上述化学方程式。
(2)稀硝酸在反应中显示出来的性质是__________ (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生2 mol NO,则转移的电子的物质的量为__________ mol。
(4)该反应中氧化剂与还原剂之比为____________ 。
(1)请配平上述化学方程式。
(2)稀硝酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生2 mol NO,则转移的电子的物质的量为
(4)该反应中氧化剂与还原剂之比为
您最近一年使用:0次
7 . 实验室可以用KClO3和50mL浓盐酸反应制取Cl2,反应原理如下:
KClO3+HCl→KCl+Cl2↑+H2O
(1)配平上述化学方程式并用双线桥标出电子转移方向与数目__________________ ;
(2)浓盐酸在上述反应中表现出来的性质是__ (填选项编号)
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为_______ (保留两位小数)
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为__________ .
KClO3+HCl→KCl+Cl2↑+H2O
(1)配平上述化学方程式并用双线桥标出电子转移方向与数目
(2)浓盐酸在上述反应中表现出来的性质是
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为
您最近一年使用:0次
8 . 实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________ 。
(2)浓盐酸在该反应中表现了____________ (选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______ mol HCl被氧化,产生的Cl2在标准状况下的体积为__________ L。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况
(2)浓盐酸在该反应中表现了
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有
您最近一年使用:0次
2018-12-30更新
|
358次组卷
|
3卷引用:河北省唐山市玉田县2018-2019学年高一上学期期中考试化学试题
解题方法
9 . 实验室用50 mL浓盐酸跟足量的氯酸钾固体共热制取氯气,该反应的化学方程式为KClO3+6HCl(浓) ===3Cl2↑+KCl+3H2O。
(1)浓盐酸在此反应中所具有的性质是__________ (填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.3 mol Cl2,求反应中转移的电子数__________ 。
(3)若反应中HCl的利用率为50%,当反应结束时,生成氯气0.15 mol,则浓盐酸的物质的量浓度为_________ 。
(1)浓盐酸在此反应中所具有的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.3 mol Cl2,求反应中转移的电子数
(3)若反应中HCl的利用率为50%,当反应结束时,生成氯气0.15 mol,则浓盐酸的物质的量浓度为
您最近一年使用:0次
10 . 请回答下列问题:
(1)已知实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为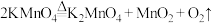 ,氧化产物是
,氧化产物是___________ (填化学式)。
(2)查阅资料可知,铜和浓 共热,发生反应
共热,发生反应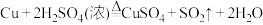 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ ,其中 在反应中表现的性质为
在反应中表现的性质为___________ 。
(3)已知反应
① ;
;
②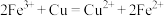 ;
;
③ ;
;
④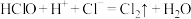 。
。
微粒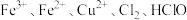 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为___________
(4)请配平下列反应方程式:___________
___________ ___________
___________ (浓)=___________
(浓)=___________ ___________
___________ ___________
___________ ___________
___________
若反应中发生氧化反应的 物质的量为
物质的量为 ,则反应中转移的电子数为
,则反应中转移的电子数为___________ 。
(1)已知实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为
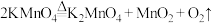 ,氧化产物是
,氧化产物是(2)查阅资料可知,铜和浓
 共热,发生反应
共热,发生反应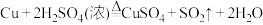 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为 在反应中表现的性质为
在反应中表现的性质为(3)已知反应
①
 ;
;②
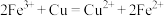 ;
;③
 ;
;④
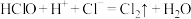 。
。微粒
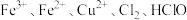 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为(4)请配平下列反应方程式:
___________
 ___________
___________ (浓)=___________
(浓)=___________ ___________
___________ ___________
___________ ___________
___________
若反应中发生氧化反应的
 物质的量为
物质的量为 ,则反应中转移的电子数为
,则反应中转移的电子数为
您最近一年使用:0次



