解题方法
1 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________ 。该反应中氧化产物是_____________ (填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________ 。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____ (填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________ (填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 已知反应:2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)请用双线桥法表示该反应___________ 。
(2)该反应的离子方程式是___________ 。
(3)浓盐酸在上述反应中显示出来的性质是___________(填序号)。
(4)该反应的氧化剂是___________ ,氧化产物是___________ ,氧化剂与还原剂的个数之比是___________ 。
(5)若生成 1 个 Cl2,则转移的电子数为___________ 。
(1)请用双线桥法表示该反应
(2)该反应的离子方程式是
(3)浓盐酸在上述反应中显示出来的性质是___________(填序号)。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(5)若生成 1 个 Cl2,则转移的电子数为
您最近一年使用:0次
名校
解题方法
3 . 自来水的消毒关系到每个人的饮水安全问题。很早以前自来水厂常用氯气作自来水的消毒剂,后来发现用氯气有不妥之处,改用了ClO2或者Na2FeO4作消毒剂。
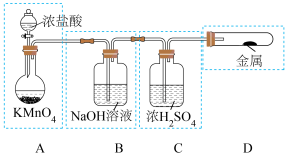
(1)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用如图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是___________ (填字母)。
(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为___________ 。
(3)工业干法制备高铁酸钾的第一步反应为: ,该反应中氧化产物为
,该反应中氧化产物为___________ 、___________ ,氧化剂和还原剂的物质的量之比为___________ 。
(4)①高铁酸钠被用作消毒剂是因为具有___________ 性,其产物是三价铁, 水解生成的Fe(OH)3分散系属于
水解生成的Fe(OH)3分散系属于___________ (填“浊液”、“胶体”或“溶液”),能够吸附水中带负电荷的固体颗粒物,达到净水的目的。
②ClO-在酸性环境下的氧化性更强,某同学准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了,下列判断可能正确的是___________ 。
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
(1)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用如图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为
(3)工业干法制备高铁酸钾的第一步反应为:
 ,该反应中氧化产物为
,该反应中氧化产物为(4)①高铁酸钠被用作消毒剂是因为具有
 水解生成的Fe(OH)3分散系属于
水解生成的Fe(OH)3分散系属于②ClO-在酸性环境下的氧化性更强,某同学准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了,下列判断可能正确的是
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目_______ 。
(2)请将上述反应改写成离子方程式________ 。
(3)浓盐酸在反应中体现出来的性质有______ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为______ g。
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是______ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:________ 。
②每生成1个FeO 转移
转移______ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个FeO
 转移
转移
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)下列物质能导电的是_______ ,属于电解质的是_______ ,属于非电解质的是_______ 。
①NaCl晶体,②液态SO2,③液态醋酸,④铜,⑤BaSO4固体,⑥纯蔗糖(C12H22O11),⑦氨水,⑧熔化的KNO3。
(2)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O。
①As2O3在上述反应中显示出来的性质是_______ 。
A.氧化性 B.还原性 C.酸性 D.碱性
②该反应的氧化产物是_______ ,还原产物是_______ 。
③若生成0.2molAsH3,则转移的电子为_______ mol。
(1)下列物质能导电的是
①NaCl晶体,②液态SO2,③液态醋酸,④铜,⑤BaSO4固体,⑥纯蔗糖(C12H22O11),⑦氨水,⑧熔化的KNO3。
(2)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O。
①As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
②该反应的氧化产物是
③若生成0.2molAsH3,则转移的电子为
您最近一年使用:0次
名校
6 .  是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 。
。
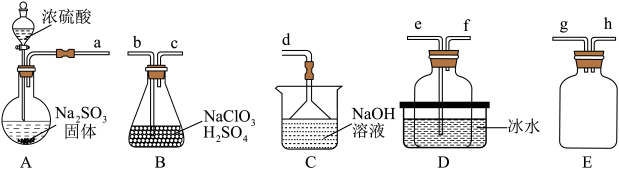
已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:
(1)A中盛装 固体的仪器名称为
固体的仪器名称为___________ 。
(2)通过装置B中反应制备 ,此反应的离子方程式为
,此反应的离子方程式为___________ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h___________ 。
(4)装置D盛放冰水的目的___________ ,装置E的作用是___________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为___________ 克(计算结果保留一位小数)。
 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 。
。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:(1)A中盛装
 固体的仪器名称为
固体的仪器名称为(2)通过装置B中反应制备
 ,此反应的离子方程式为
,此反应的离子方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h(4)装置D盛放冰水的目的
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
7 . 实验室可用KMnO4和浓盐酸反应制取氯气,反应原理:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O。
(1)用双线桥标出电子得失情况:___________ 。
(2)由此反应可以推断氧化性强弱KMnO4___________ Cl2(填“>”、“<”或“=”)。
(3)浓盐酸在反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若参加反应的HCl是73g,则被氧化的HCl有___________ g(保留一位小数点)。
(5)某同学设计如下实验探究H2O2的性质:
①从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是___________ 。
②能证明H2O2具有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ 。
(6)将反应配平:____________________ 。
______OH-+______ClO-+______Fe3+=_______ +_____Cl-+______H2O
+_____Cl-+______H2O
(1)用双线桥标出电子得失情况:
(2)由此反应可以推断氧化性强弱KMnO4
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若参加反应的HCl是73g,则被氧化的HCl有
(5)某同学设计如下实验探究H2O2的性质:
| 序号 | 实验 | 实验现象 |
| ⅰ | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去;b.有大量气泡产生 |
| ⅱ | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(6)将反应配平:
______OH-+______ClO-+______Fe3+=_______
 +_____Cl-+______H2O
+_____Cl-+______H2O
您最近一年使用:0次
解题方法
8 . Ⅰ、已知Mg与HNO3反应的化学方程式如下(未配平):
___________Mg+___________HNO3(稀)=___________Mg(NO3)2+___________NO↑+___________H2O
(1)请配平上述化学方程式,并用双线桥法表示电子转移的方向和数目___________ 。
(2)把上述化学方程式改写成离子方程式___________ 。
(3)该反应中,氧化剂是___________ ,还原产物是___________ ,n(氧化剂)︰n(还原剂)=___________ 。
(4)HNO3在上述反应中显示出来的性质是___________。
(5)当转移1.806×1023个电子时,生成的NO气体的体积(标准状况下)为___________ 。
Ⅱ、Mn2+、Bi3+、BiO 、MnO
、MnO 、H+、H2O组成的一个氧化还原反应体系中,发生BiO
、H+、H2O组成的一个氧化还原反应体系中,发生BiO →Bi3+的反应过程。
→Bi3+的反应过程。
(6)该反应中,被氧化的元素是___________ ,氧化剂是___________ 。
(7)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式:___________ 。·
___________+___________+___________→___________+___________+H2O
___________Mg+___________HNO3(稀)=___________Mg(NO3)2+___________NO↑+___________H2O
(1)请配平上述化学方程式,并用双线桥法表示电子转移的方向和数目
(2)把上述化学方程式改写成离子方程式
(3)该反应中,氧化剂是
(4)HNO3在上述反应中显示出来的性质是___________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
Ⅱ、Mn2+、Bi3+、BiO
 、MnO
、MnO 、H+、H2O组成的一个氧化还原反应体系中,发生BiO
、H+、H2O组成的一个氧化还原反应体系中,发生BiO →Bi3+的反应过程。
→Bi3+的反应过程。(6)该反应中,被氧化的元素是
(7)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
___________+___________+___________→___________+___________+H2O
您最近一年使用:0次
名校
9 . 某同学用MnO2和浓盐酸反应制氯气并设计如下实验装置制取氯化铁。回答下列问题:

(1)装置B的作用是___________ 。
(2)装置E中发生反应的离子方程式:___________ 。
(3)装置A中发生反应的氧化剂是___________ (填化学式),浓盐酸在该反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)装置A中,若反应生成氯气的体积为2.24L(标准状况下),则反应中被氧化的HCl的物质的量为___________ mol。
(5)装置D中发生反应的化学方程式:___________ 。

(1)装置B的作用是
(2)装置E中发生反应的离子方程式:
(3)装置A中发生反应的氧化剂是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)装置A中,若反应生成氯气的体积为2.24L(标准状况下),则反应中被氧化的HCl的物质的量为
(5)装置D中发生反应的化学方程式:
您最近一年使用:0次
2023-11-14更新
|
107次组卷
|
2卷引用:陕西省西咸新区2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
10 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______ ;丁属于_______ (“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_______ (填化学式);根据氯元素的化合价判断,乙物质的性质_______ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为: (未配平),配平后参与反应的甲与H2O的微粒个数之比是
(未配平),配平后参与反应的甲与H2O的微粒个数之比是_______ 。
(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为_______ 。庚与洁厕灵(主要成分盐酸)同时使用会产生有毒的氯气,写出反应的离子方程式:_______ 。
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为_______
(6)工业上可以用草酸(H2C2O4,二元弱酸)还原辛的方法生产丙,草酸被氧化为CO2,请写出该反应的离子方程式_______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:
 (未配平),配平后参与反应的甲与H2O的微粒个数之比是
(未配平),配平后参与反应的甲与H2O的微粒个数之比是(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为
(6)工业上可以用草酸(H2C2O4,二元弱酸)还原辛的方法生产丙,草酸被氧化为CO2,请写出该反应的离子方程式
您最近一年使用:0次



