1 . 回答下列问题:
(1)写出纯碱的化学式:_______ 。
(2)写出氯气和水反应的化学方程式:_______ 。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式:_______ 。
(4)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+8H2O+5Cl2↑,
则①氧化剂为:_______ 。
②反应中氯化氢表现出的性质是_______ (填写字母)。
a.还原性 b.酸性 c.氧化性
③若生成标准状况下22.4 Cl2则转移电子总数是_______ mol。
(1)写出纯碱的化学式:
(2)写出氯气和水反应的化学方程式:
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式:
(4)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+8H2O+5Cl2↑,
则①氧化剂为:
②反应中氯化氢表现出的性质是
a.还原性 b.酸性 c.氧化性
③若生成标准状况下22.4 Cl2则转移电子总数是
您最近一年使用:0次
2 . 实验室可以根据下列方程式制备氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)_________ 。
(2)用双线桥法表示该反应中电子转移的方向和数目_________ 。
(3)浓盐酸在该反应中的作用是(填序号)_________ ①氧化性②还原性③酸性,若在标准状况下,制得氯气的体积为2.24L,则被氧化的氯化氢的物质的量为_________ 。
 MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)
(2)用双线桥法表示该反应中电子转移的方向和数目
(3)浓盐酸在该反应中的作用是(填序号)
您最近一年使用:0次
名校
3 . 已知高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,反应如下:MnO +Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
+Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
 +Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
+Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是A.MnO 是氧化剂,Fe3+是还原产物 是氧化剂,Fe3+是还原产物 | B.生成四个水分子时,转移10个电子 |
| C.硫酸体现了氧化性和酸性 | D.Fe2+的还原性强于Mn2+ |
您最近一年使用:0次
2022-11-09更新
|
163次组卷
|
2卷引用:浙江省A9协作体2022-2023学年高一上学期期中联考化学试题
4 . 由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2的一半。这一反应的化学方程式是___________ 。
(2)浓盐酸在上述反应中显示出来的性质是___________(填写编号)。
(3)若上述反应产生0.1 mol Cl2,转移电子的物质的量为___________ mol。
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是___________ 。和欧洲的方法相比,我国这一方法的主要优点是___________ 。
(1)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2的一半。这一反应的化学方程式是
(2)浓盐酸在上述反应中显示出来的性质是___________(填写编号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是
您最近一年使用:0次
解题方法
5 . 关于反应 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是A.该反应体现了 的强氧化性和酸性 的强氧化性和酸性 |
| B.反应生成22.4L(标况下)NO气体时转移3mol电子 |
| C.该反应中氧化产物只有S |
D.若设计成原电池, 作为负极材料 作为负极材料 |
您最近一年使用:0次
19-20高一·浙江·期中
6 . 实验室用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液,制备氯气。
(1)该反应的离子方程式为:__________________________________________________ ,该盐酸的物质的量浓度为_______________ mol/L。
(2)生成1molCl2时,转移的电子数目为_______________ 。
(3) 8.7gMnO2与足量浓盐酸反应能使_____________ molHCl被氧化:
(4)浓盐酸在反应中显示出来的性质是___________ .(填字母)
a.还原性b.酸性c.氧化性d.挥发性
(5)用氢氧化钠溶液吸收多余的氯气(用离子方程式表示):_____________________ 。
(1)该反应的离子方程式为:
(2)生成1molCl2时,转移的电子数目为
(3) 8.7gMnO2与足量浓盐酸反应能使
(4)浓盐酸在反应中显示出来的性质是
a.还原性b.酸性c.氧化性d.挥发性
(5)用氢氧化钠溶液吸收多余的氯气(用离子方程式表示):
您最近一年使用:0次
20-21高一上·浙江绍兴·阶段练习
7 . Ca(ClO)2与浓盐酸反应生成Cl2,反应方程式:Ca(ClO)2+4HCl浓)=CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是___ (填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为___ mol。
(1)浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为
您最近一年使用:0次
19-20高一·浙江·阶段练习
解题方法
8 . 下下列反应均可用于实验室制备氯气:
①MnO2+4HCl (浓) MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
回答下列问题:
(1)请将反应①改写为离子方程式:____________ 。
(2)用双线桥标出反应②的电子转移方向和数目:__________ 。
(3)用单线桥标出反应③的电子转移方向和数目:___________
(4)比较反应①②中氧化剂的氧化性强弱____________ 。
(5)上述反应中浓盐酸显示出来的性质是_________ (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(6)若反应①中有17.4 g纯MnO2被还原,则反应①中被氧化的氯化氢的质量为______ 。
(7)当反应①中生成3.01×1023个氯气分子时,则转移的电子数为_____ 。
(8)工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl 固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式__________ ,其反应中被氧化的原子与被还原的原子个数之比为_____ 。
①MnO2+4HCl (浓)
 MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。②KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
回答下列问题:
(1)请将反应①改写为离子方程式:
(2)用双线桥标出反应②的电子转移方向和数目:
(3)用单线桥标出反应③的电子转移方向和数目:
(4)比较反应①②中氧化剂的氧化性强弱
(5)上述反应中浓盐酸显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(6)若反应①中有17.4 g纯MnO2被还原,则反应①中被氧化的氯化氢的质量为
(7)当反应①中生成3.01×1023个氯气分子时,则转移的电子数为
(8)工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl 固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式
您最近一年使用:0次
名校
9 . 下面两个方法都可以用来制氯气:
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
(1)反应①的离子方程式为____________ 。
(2)浓盐酸在反应①中显示出来的性质是____________ 。
A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为____________ g。
(3)用双线桥法表示该反应②中电子转移的方向和数目。____________
(4)若要制得相同质量的氯气,反应①②中电子转移的数目之比为____________ 。
(5)已知反应④:4HCl+O2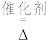 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为____________ 。
①MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
(1)反应①的离子方程式为
(2)浓盐酸在反应①中显示出来的性质是
A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为
(3)用双线桥法表示该反应②中电子转移的方向和数目。
(4)若要制得相同质量的氯气,反应①②中电子转移的数目之比为
(5)已知反应④:4HCl+O2
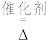 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
您最近一年使用:0次
2020-11-12更新
|
264次组卷
|
3卷引用:浙江省丽水市五校共同体2020-2021学年高一10月阶段性考试化学试题
名校
10 . 下列关于氧化还原反应的说法正确的是
| A.1mol Na2O2参与氧化还原反应,电子转移数一定为NA (NA为阿伏加 德罗常数的值) |
| B.浓HCl和MnO2制氯气的反应中,参与反应的HCl中体现酸性和氧化性各占一半 |
| C.VC可以防止亚铁离子转化成三价铁离子,主要原因是VC具有较强的还原性 |
| D.NO2与水反应,氧化剂和还原剂的物质的量之比为2: 1 |
您最近一年使用:0次
2020-05-02更新
|
325次组卷
|
3卷引用:浙江省绍兴市柯桥区2020届高三上学期1月模拟普通高校招生考试化学试题



