解题方法
1 .  是一种氧化剂,可以用来制取氯气。
是一种氧化剂,可以用来制取氯气。
(1)高锰酸钾溶于水的电离方程式为_______ 。它属于_______ (选填“强电解质”、“弱电解质”、“非电解质”);
(2)已知高锰酸钾固体在室温下能将浓盐酸氧化,发生反应: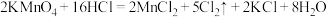
①标明上述化学方程式电子转移方向和数目_______ 。
②在该反应中,被还原的元素是_______ ,浓盐酸体现了_______ 性质(选填字母编号),氧化剂与还原剂的物质的量之比为_______ 。
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
③产生 ,则转移的电子数目为
,则转移的电子数目为_______ 。
④下列装置中,可用作该反应的气体发生装置的是(选填字母编号)_______ 。
A.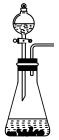 B.
B. 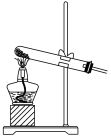 C.
C. 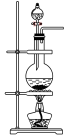
⑤用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放_______ ,装置E中可盛放_______ (均选填字母编号)
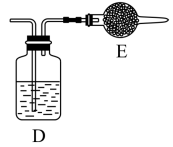
A. 浓硫酸 B. NaOH溶液 C. 饱和食盐水 D. 固体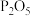 E. 碱石灰
E. 碱石灰
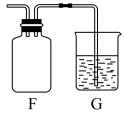
⑥氯气可用排空气法收集,装置G中盛放为NaOH溶液,作用是_______ ,并写出反应的离子方程式_______ 。
(3)实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:
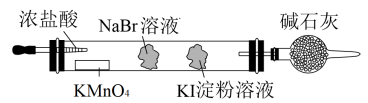
该装置中,吸有KI淀粉溶液的棉球颜色变为_______ 。吸有NaBr溶液的棉球中发生反应的离子方程式为_______ 。由反应现象能否得出活泼性 的结论?回答并说明理由
的结论?回答并说明理由_______ 。
(4)COVID-19在全球的蔓延,对人类的健康和全球的经济带来了很大的影响,为了控制疫情,全球进行了大面积的消杀工作,消毒液发挥了重要的作用,请回答下列有关消毒液的问题。
①生产消毒液是将氯气通入NaOH溶液中,取少量该消毒液滴加酸性 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有_______ (填离子符号)。
②消毒液稀释后喷洒在空气中,可以生成有漂白性的物质和碳酸氢钠,请写出此过程的化学方程式:_______ ;该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学方程式:_______ 。
 是一种氧化剂,可以用来制取氯气。
是一种氧化剂,可以用来制取氯气。(1)高锰酸钾溶于水的电离方程式为
(2)已知高锰酸钾固体在室温下能将浓盐酸氧化,发生反应:
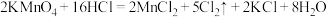
①标明上述化学方程式电子转移方向和数目
②在该反应中,被还原的元素是
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
③产生
 ,则转移的电子数目为
,则转移的电子数目为④下列装置中,可用作该反应的气体发生装置的是(选填字母编号)
A.
 B.
B.  C.
C. 
⑤用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放

A. 浓硫酸 B. NaOH溶液 C. 饱和食盐水 D. 固体
 E. 碱石灰
E. 碱石灰⑥氯气可用排空气法收集,装置G中盛放为NaOH溶液,作用是

(3)实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:

该装置中,吸有KI淀粉溶液的棉球颜色变为
 的结论?回答并说明理由
的结论?回答并说明理由(4)COVID-19在全球的蔓延,对人类的健康和全球的经济带来了很大的影响,为了控制疫情,全球进行了大面积的消杀工作,消毒液发挥了重要的作用,请回答下列有关消毒液的问题。
①生产消毒液是将氯气通入NaOH溶液中,取少量该消毒液滴加酸性
 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有②消毒液稀释后喷洒在空气中,可以生成有漂白性的物质和碳酸氢钠,请写出此过程的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
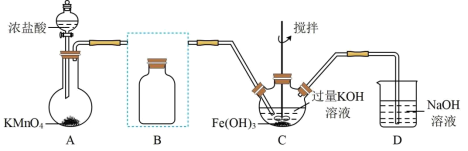
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
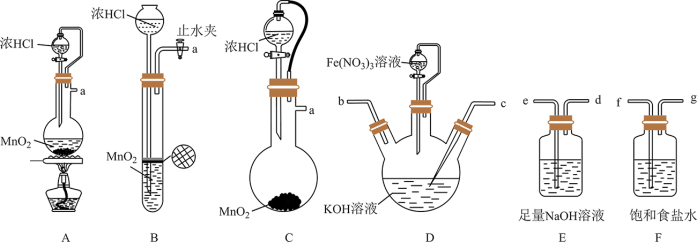
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
名校
解题方法
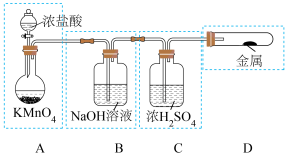
3 . 自来水的消毒关系到每个人的饮水安全问题。很早以前自来水厂常用氯气作自来水的消毒剂,后来发现用氯气有不妥之处,改用了ClO2或者Na2FeO4作消毒剂。
(1)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用如图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是___________ (填字母)。
(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为___________ 。
(3)工业干法制备高铁酸钾的第一步反应为: ,该反应中氧化产物为
,该反应中氧化产物为___________ 、___________ ,氧化剂和还原剂的物质的量之比为___________ 。
(4)①高铁酸钠被用作消毒剂是因为具有___________ 性,其产物是三价铁, 水解生成的Fe(OH)3分散系属于
水解生成的Fe(OH)3分散系属于___________ (填“浊液”、“胶体”或“溶液”),能够吸附水中带负电荷的固体颗粒物,达到净水的目的。
②ClO-在酸性环境下的氧化性更强,某同学准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了,下列判断可能正确的是___________ 。
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
(1)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用如图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为
(3)工业干法制备高铁酸钾的第一步反应为:
 ,该反应中氧化产物为
,该反应中氧化产物为(4)①高铁酸钠被用作消毒剂是因为具有
 水解生成的Fe(OH)3分散系属于
水解生成的Fe(OH)3分散系属于②ClO-在酸性环境下的氧化性更强,某同学准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了,下列判断可能正确的是
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
您最近一年使用:0次
名校
解题方法
4 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_______ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是_______ 。
a. b.
b. c.
c.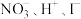 d.
d.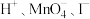
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉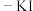 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①猜想1为_______ ,实验1所用试剂 为
为_______ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为_______ 。
(5)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等数量的四种氧化剂微粒分别与足量 作用,得到
作用,得到 最多的是
最多的是_______ 。
(6)结合上述信息思考:对于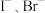 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_______ ;②加入_______ 。
(7) 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的_______ 倍(保留两位有效数字)。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 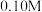 (M为物质的量浓度的单位) (M为物质的量浓度的单位) | |||||
电位值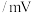 | 171 | 1130 | 603 | 662 | 116 | 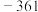 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.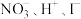 d.
d.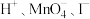
(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉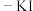 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | 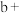 稀 稀 | 溶液变蓝 |
 为
为②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
(5)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(6)结合上述信息思考:对于
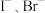 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(7)
 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的
您最近一年使用:0次
名校
解题方法
5 . 研究SO2的性质对SO2的污染防治与利用意义重大。
Ⅰ.SO2性质探究
(1)从物质分类角度看,SO2属于酸性氧化物。写出用足量氨水吸收SO2的化学方程式:______ 。
(2)从元素价态看,SO2中S元素为+4价,既具有氧化性又具有还原性。为探究SO2的还原性,设计如图所示的装置,将SO2通入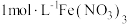 和BaCl2混合溶液中,观察到有白色沉淀生成。
和BaCl2混合溶液中,观察到有白色沉淀生成。 ,
, 与Ba2+反应生成白色沉淀。
与Ba2+反应生成白色沉淀。 与Fe3+反应放热的离子方程式为
与Fe3+反应放热的离子方程式为_____ 。
②乙同学认为甲同学的分析有失偏颇,其理由是______ 。
Ⅱ.SO2综合利用
(3)工业上常用足量的Na2CO3溶液吸收工业尾气中的SO2,将其转化为一种正盐,同时生成一种酸式盐,写出反应的化学方程式:______ 。
(4)一定条件下,SO2与H2O可发生催化反应: 。该工艺中若消耗3molSO2,转移的电子为
。该工艺中若消耗3molSO2,转移的电子为______ mol。
Ⅲ.空气质量测定
(5)SO2气体会引起酸雨,酸雨是pH小于______ 的雨水。
(6)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。用注射器缓缓推入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,该空气中二氧化硫的体积分数为______ (用含V的代数式表示,已知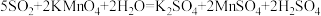 )。
)。
Ⅰ.SO2性质探究
(1)从物质分类角度看,SO2属于酸性氧化物。写出用足量氨水吸收SO2的化学方程式:
(2)从元素价态看,SO2中S元素为+4价,既具有氧化性又具有还原性。为探究SO2的还原性,设计如图所示的装置,将SO2通入
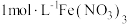 和BaCl2混合溶液中,观察到有白色沉淀生成。
和BaCl2混合溶液中,观察到有白色沉淀生成。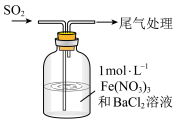
 ,
, 与Ba2+反应生成白色沉淀。
与Ba2+反应生成白色沉淀。 与Fe3+反应放热的离子方程式为
与Fe3+反应放热的离子方程式为②乙同学认为甲同学的分析有失偏颇,其理由是
Ⅱ.SO2综合利用
(3)工业上常用足量的Na2CO3溶液吸收工业尾气中的SO2,将其转化为一种正盐,同时生成一种酸式盐,写出反应的化学方程式:
(4)一定条件下,SO2与H2O可发生催化反应:
 。该工艺中若消耗3molSO2,转移的电子为
。该工艺中若消耗3molSO2,转移的电子为Ⅲ.空气质量测定
(5)SO2气体会引起酸雨,酸雨是pH小于
(6)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。用注射器缓缓推入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,该空气中二氧化硫的体积分数为
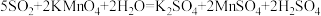 )。
)。
您最近一年使用:0次
2023-05-04更新
|
395次组卷
|
3卷引用:广东省惠州市惠阳区第五中学,惠阳叶挺中学2022-2023学年高一下学期3月月考化学试题
名校
6 . 二氧化氯( )具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过
)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过 与酸性
与酸性 溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备
溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备 并探究其性质。
并探究其性质。
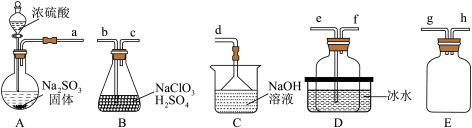
已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 。回答下列问题:
。回答下列问题:
(1)A中盛装浓 的仪器名称是
的仪器名称是_______ 。
(2)通过装置B中反应制备 ,其化学反应方程式为
,其化学反应方程式为_______ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a→g→h→
,选择上图中的装置,其接口的连接顺序为a→g→h→_______ 。
(4)装置D盛放冰水的目的是_______ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为_______ g。(计算结果保留一位小数)
 )具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过
)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过 与酸性
与酸性 溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备
溶液反应制备。某化学兴趣小组同学设计了如图所示装置制备 并探究其性质。
并探究其性质。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 。回答下列问题:
。回答下列问题:(1)A中盛装浓
 的仪器名称是
的仪器名称是(2)通过装置B中反应制备
 ,其化学反应方程式为
,其化学反应方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a→g→h→
,选择上图中的装置,其接口的连接顺序为a→g→h→(4)装置D盛放冰水的目的是
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2022-12-22更新
|
90次组卷
|
2卷引用:湖北省武汉市水果湖高中2022-2023学年高一上学期10月月考化学试题
名校
解题方法
7 . 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___ ,反应过程中持续通入氮气的目的是__ 。
(2)(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:__ 。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:__ 。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
①在___ (填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为__ ;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为__ g(用含V1的代数式表示,5H2O2~2MnO )。
)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)图中装有NaOH溶液的仪器的名称为
(2)(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
②若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
 )。
)。
您最近一年使用:0次
名校
8 . 由我国自主研发的“奋斗者号”潜水艇在太平洋马里亚纳海沟成功坐底,创造了中国载人深潜的新纪录。
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为___________ ;写出Na2O2和CO2反应的化学方程式:___________ ,该反应中生成一个O2时,转移的___________ 个电子。
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。_______
___________MnO +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________
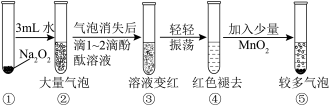
(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应: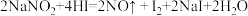 ,上述反应中氧化剂是
,上述反应中氧化剂是___________ ,氧化产物是___________ ,HI在反应中体现了___________ 性。
②根据上述反应鉴别NaNO2和NaCl。可选用的物质有___________ (填序号)。
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO
 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。
___________MnO
 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。

| A.②中的大量气泡主要成分是氢气 |
| B.③中溶液变红,说明有酸性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
| D.⑤中MnO2的主要作用是验证溶液中存在过氧化氢 |
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应:
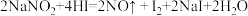 ,上述反应中氧化剂是
,上述反应中氧化剂是②根据上述反应鉴别NaNO2和NaCl。可选用的物质有
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
您最近一年使用:0次
9 . 高铁酸钾 (K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与 反应制备
反应制备
(1)氯气的发生装置可以选择图中的_______ (用图中大写字母表示);化学反应方程式为_______ 。
(2)选择上述装置,制备 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。_________
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下:
在硫酸溶液中反应如下:
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。__________
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。
Ⅱ.干法制备高铁酸钾的主要反应为: 。
。
(4)①该反应中的还原剂是_______ 。
②每生成 转移
转移_______ 个电子(阿伏加德罗常数用 表示)。
表示)。
(5)简要说明 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用_______ 。
 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与
 反应制备
反应制备

(1)氯气的发生装置可以选择图中的
(2)选择上述装置,制备
 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下:
在硫酸溶液中反应如下: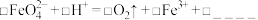
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
Ⅱ.干法制备高铁酸钾的主要反应为:
 。
。(4)①该反应中的还原剂是
②每生成
 转移
转移 表示)。
表示)。(5)简要说明
 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用
您最近一年使用:0次
名校
解题方法
10 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
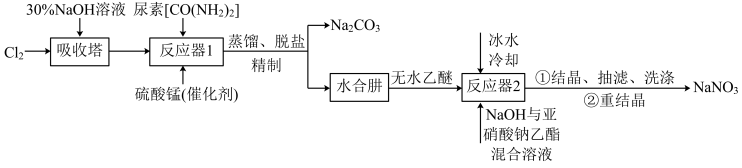
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为_______ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(3)反应器2中加入无水乙醚的作用是_______ 。
(4)已知亚硝酸乙酯的结构简式为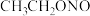 ,反应器2中生成
,反应器2中生成 和
和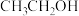 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为_______ 。
(5)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(6)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
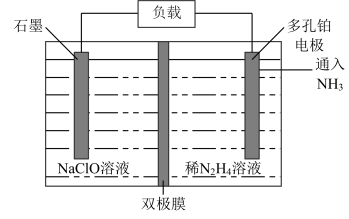
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为
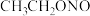 ,反应器2中生成
,反应器2中生成 和
和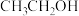 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为(5)反应器1要控制NaClO溶液的用量,其主要目的是
(6)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
您最近一年使用:0次



