1 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
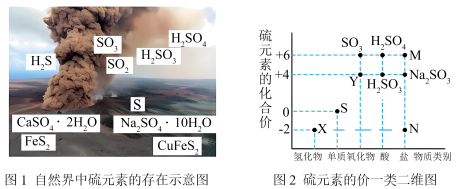
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。
(2) 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(4)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与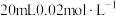 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(5) 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:

请回答下列问题:
①反应b的化学方程式为:___________ 。
②在一段时间内连续不断测定溶液 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:___________ 。
③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:___________ 。
(6)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成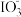 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(7)雌黄( )和雄黄(
)和雄黄(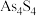 )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为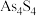 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
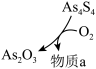
② 和
和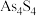 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为___________ ,消耗氧气___________  。
。

(1)图1中与图2中M、N对应的物质分别是
(2)
 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与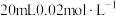 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)
 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
请回答下列问题:
①反应b的化学方程式为:
②在一段时间内连续不断测定溶液
 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:
(6)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成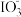 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(7)雌黄(
 )和雄黄(
)和雄黄(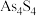 )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为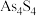 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和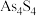 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为 。
。
您最近一年使用:0次
名校
2 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ 。
(2)c的浓溶液能与 反应的化学方程为
反应的化学方程为_____
(3)将足量的a通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)实验室洗涤试管壁上附着的硫单质可用热的 溶液洗涤,该反应原理为
溶液洗涤,该反应原理为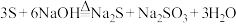
①在该反应中,氧化剂和还原剂的物质的量之比为_____ 。
②向上述反应的溶液中再加入适量的稀 ,会产生淡黄色沉淀,写出该反应的离子方程式:
,会产生淡黄色沉淀,写出该反应的离子方程式:_____ 。
(5)已知e为正盐,能被酸性 氧化为
氧化为 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:_____ 。
(6)下列反应过程中的能量变化可用图表示的是_____ 。(填序号)
⑤食物因氧化而腐败;⑥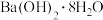 与
与 反应;⑦氧化钙与水反应
反应;⑦氧化钙与水反应
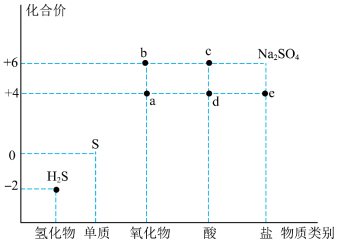
(2)c的浓溶液能与
 反应的化学方程为
反应的化学方程为(3)将足量的a通入
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)实验室洗涤试管壁上附着的硫单质可用热的
 溶液洗涤,该反应原理为
溶液洗涤,该反应原理为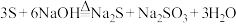
①在该反应中,氧化剂和还原剂的物质的量之比为
②向上述反应的溶液中再加入适量的稀
 ,会产生淡黄色沉淀,写出该反应的离子方程式:
,会产生淡黄色沉淀,写出该反应的离子方程式:(5)已知e为正盐,能被酸性
 氧化为
氧化为 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(6)下列反应过程中的能量变化可用图表示的是
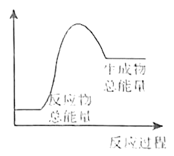
⑤食物因氧化而腐败;⑥
 与
与 反应;⑦氧化钙与水反应
反应;⑦氧化钙与水反应
您最近一年使用:0次
名校
解题方法
3 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
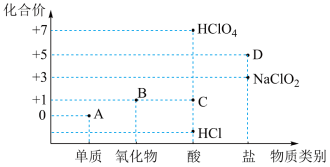
(1)已知D可用于实验室制 ,其阳离子为
,其阳离子为 。A、B、C、D四种物质中,属于电解质的是
。A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于_______ (填“酸性”或“碱性”)氧化物。
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则D分解的化学方程式为_______ 。
(4)浓HCl与D可制得单质A,请写出相应的化学方程式并用双线桥法表示电子转移的方向与数目_______ 。
(5) 是一种高效的消毒剂和漂白剂。工业用Mathieson法制备
是一种高效的消毒剂和漂白剂。工业用Mathieson法制备 的流程如下:
的流程如下:
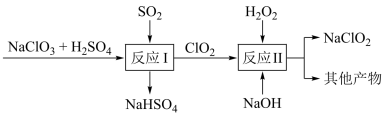
反应I中氧化剂与氧化产物的物质的量之比为_______ ;反应II的离子方程式是_______ 。

(1)已知D可用于实验室制
 ,其阳离子为
,其阳离子为 。A、B、C、D四种物质中,属于电解质的是
。A、B、C、D四种物质中,属于电解质的是(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则D分解的化学方程式为
(4)浓HCl与D可制得单质A,请写出相应的化学方程式并用双线桥法表示电子转移的方向与数目
(5)
 是一种高效的消毒剂和漂白剂。工业用Mathieson法制备
是一种高效的消毒剂和漂白剂。工业用Mathieson法制备 的流程如下:
的流程如下:
反应I中氧化剂与氧化产物的物质的量之比为
您最近一年使用:0次
4 . 氨元素是动植物生长不可缺少的元素,图1是自然界中氨元素的循环示意图,图2是氨元素的常见化合价与部分物质类别的对应关系。回答下列问题:
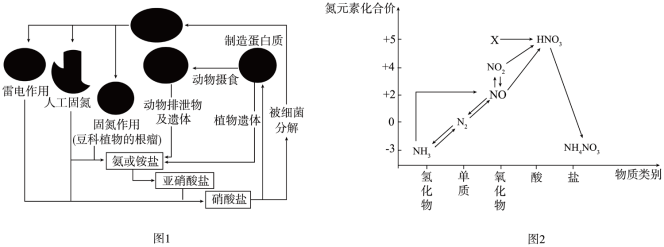
(1)图1中属于固氮过程的是_______ (写两种即可)。
(2) 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。
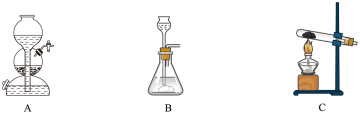
①下列各装置中常用于实验室制备氨气的是_______ (填字母),利用该装置制备氨气的化学方程式为_______ 。
② 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
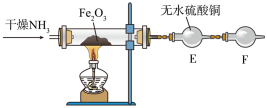
写出氨气与氧化铁反应的化学方程式:_______ 。干燥管F中装有无水氯化钙,其作用是_______ 。
(3)图2中物质X的化学式是_______ ,其与水反应生成 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为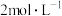 ,硝酸的浓度为
,硝酸的浓度为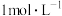 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为_______ (假设只生成一种气体),最多可收集到标准状况下的该气体的体积为_______ L。

(1)图1中属于固氮过程的是
(2)
 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。①下列各装置中常用于实验室制备氨气的是

②
 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
写出氨气与氧化铁反应的化学方程式:
(3)图2中物质X的化学式是
 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为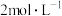 ,硝酸的浓度为
,硝酸的浓度为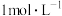 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
您最近一年使用:0次
解题方法
5 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
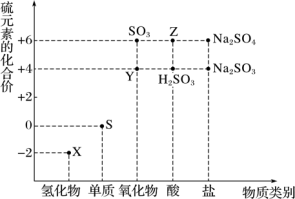
(1)将X与Y混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)Z 的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(3) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备 Na2S2O3的方案理论上可行的是_______ (填字母) 。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知 Na2SO3能被 K2Cr2O7氧化为Na2SO4,则 24 mL 0.05 mol·L-1的 Na2SO3溶液与 20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr 元素在还原产物中的化合价为_______ 。

(1)将X与Y混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(2)Z 的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(3) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备 Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知 Na2SO3能被 K2Cr2O7氧化为Na2SO4,则 24 mL 0.05 mol·L-1的 Na2SO3溶液与 20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr 元素在还原产物中的化合价为
您最近一年使用:0次
名校
解题方法
6 . 氧化性:Br2 > Fe3+> I2,向含 a mol FeI2和 a mol BaCl2的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是
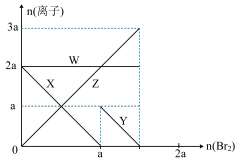

| A.离子的还原性 I-> Fe2+> Br- |
| B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl- |
| C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8 |
| D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br- |
您最近一年使用:0次
2020-04-21更新
|
307次组卷
|
2卷引用:浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题
名校
7 . 有A、B两种常见化合物,其焰色试验均呈黄色,C是一种单质气体,相互转化关系如下图所示(部分生成物已略去)。回答下列问题:

(1)A的化学式为_______ ,用化学方程式表示A的用途_______ ,上述反应消耗2mol A时,制得气体的质量为_______ ,转移电子总数约为_______ 个。
(2)简述鉴别E与纯碱的一种方法_______ 。
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为_______ ,气体产物有_______ 。
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为_______ 或_______ 。

(1)A的化学式为
(2)简述鉴别E与纯碱的一种方法
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为
您最近一年使用:0次
解题方法
8 . 含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式:_____________________ 。
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8gKMnO4能氧化_______ molHCl,产生的Cl2在标准状况下的体积为_____ L。
(2)常温下,氯气与烧碱溶液反应得84消毒液,NaClO是84消毒液的有效成分,在抗击新型冠状病毒中发挥了重要作用。浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示:____________________________ (已知酸性:H2CO3>HClO> )。
)。
(3)某温度下,将aL(已换算成标况体积)氯气通入由24gNaOH配成的溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1:3。
的个数比为1:3。
①a=______ L;
②写出该反应的化学方程式:______________________________ 。
(1)①写出实验室中制取氯气的离子方程式:
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8gKMnO4能氧化
(2)常温下,氯气与烧碱溶液反应得84消毒液,NaClO是84消毒液的有效成分,在抗击新型冠状病毒中发挥了重要作用。浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示:
 )。
)。(3)某温度下,将aL(已换算成标况体积)氯气通入由24gNaOH配成的溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与
 的个数比为1:3。
的个数比为1:3。①a=
②写出该反应的化学方程式:
您最近一年使用:0次
名校
9 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: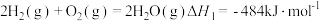
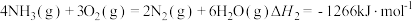
则 的
的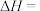
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为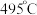 时,
时,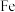 的温度为
的温度为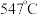 ,而
,而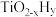 的温度为
的温度为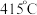 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为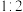 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的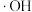 (羟基自由基),
(羟基自由基),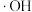 能将
能将 快速氧化为
快速氧化为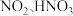 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
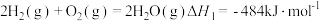
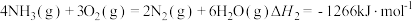
则
 的
的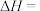
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为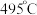 时,
时,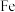 的温度为
的温度为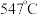 ,而
,而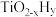 的温度为
的温度为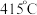 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是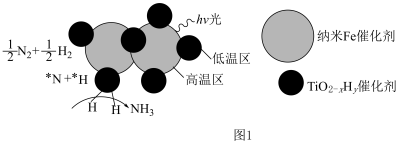
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性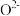 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。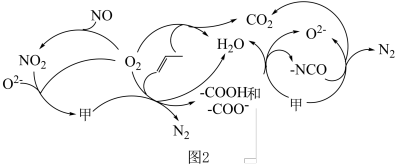
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为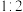 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中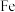 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的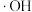 (羟基自由基),
(羟基自由基),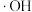 能将
能将 快速氧化为
快速氧化为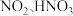 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: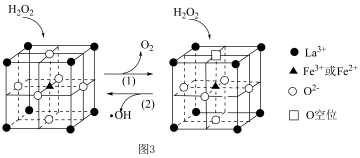
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
10 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: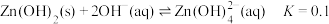 ;
;
②室温下,部分离子浓度的对数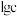 与
与 的关系如下图所示(其中
的关系如下图所示(其中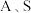 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物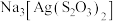 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: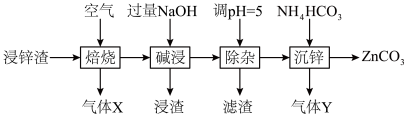
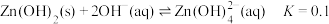 ;
;②室温下,部分离子浓度的对数
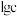 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):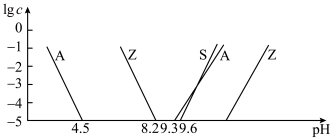
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
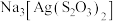 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
209次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题



