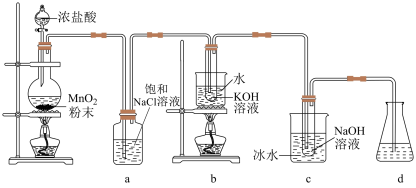
1 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: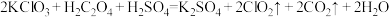 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: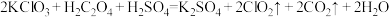 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
名校
2 . 四氯化碳主要用作优良的溶剂、干洗剂、灭火剂、制冷剂、香料的浸出剂以及农药等,也可用于有机合成,工业上可用二硫化碳与氯气反应制取四氯化碳。某化学小组用下图实验装置模拟工业制备四氯化碳。

已知:① 可与溴水反应生成硫酸和氢溴酸;
可与溴水反应生成硫酸和氢溴酸;
② 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6 g/cm
的沸点76.8℃、密度1.6 g/cm 。
。
(1)A装置中盛放 的仪器名称为
的仪器名称为___________ 导管K的作用为___________ 。
(2)上述装置的连接顺序为
a→___________→___________→___________→___________→___________→___________→___________→___________→______________________
(3)反应结束后关闭 ,
, ,此时F装置的作用为
,此时F装置的作用为___________ 。
(4)装置B中若1 mol 完全反应,转移的电子数目为
完全反应,转移的电子数目为___________ 。
(5)反应结束先过滤除去固体催化剂,再经过___________ (填操作名称)可得到 。
。
(6)若用 提取碘水中的碘单质,振荡静置后的现象为
提取碘水中的碘单质,振荡静置后的现象为___________ 。

已知:①
 可与溴水反应生成硫酸和氢溴酸;
可与溴水反应生成硫酸和氢溴酸;②
 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6 g/cm
的沸点76.8℃、密度1.6 g/cm 。
。(1)A装置中盛放
 的仪器名称为
的仪器名称为(2)上述装置的连接顺序为
a→___________→___________→___________→___________→___________→___________→___________→___________→___________
(3)反应结束后关闭
 ,
, ,此时F装置的作用为
,此时F装置的作用为(4)装置B中若1 mol
 完全反应,转移的电子数目为
完全反应,转移的电子数目为(5)反应结束先过滤除去固体催化剂,再经过
 。
。(6)若用
 提取碘水中的碘单质,振荡静置后的现象为
提取碘水中的碘单质,振荡静置后的现象为
您最近一年使用:0次
名校
3 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知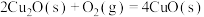
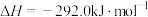 ;则
;则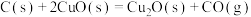 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中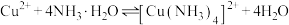 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知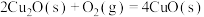
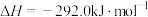 ;则
;则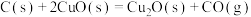 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 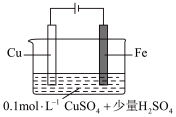 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 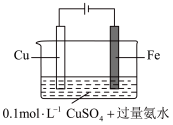 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中 平衡不移动,理由是
平衡不移动,理由是
您最近一年使用:0次
2024-01-01更新
|
214次组卷
|
2卷引用:湖北省九师联盟2024届高三11月质检化学试题
名校
解题方法
4 . 氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以VOCl2和NH4HCO3为原料制备氧钒( Ⅳ )碱式碳酸铵晶体的装置如图所示。
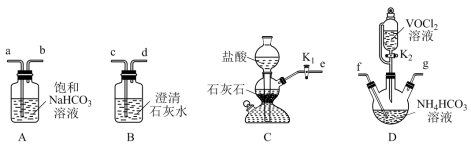
已知:+4价钒的化合物易被氧化。
回答下列问题:
(1)装置D中盛放NH4HCO3溶液的仪器名称是______ ;上述装置依次连接的合理顺序为e→______ (按气流方向,用小写字母表示)。
(2)实验开始时,先关闭K2,打开K1,当______ (填实验现象)时,关闭K1,打开K2,进行实验。
(3)实验完毕后,从装置D中分离产品的操作方法是_____ (填操作名称)。
(4)测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用20 mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知: +Fe2++2H+= VO2++Fe3++H2O)
+Fe2++2H+= VO2++Fe3++H2O)
① 中V的化合价
中V的化合价_____________ 。
②过量KMnO4溶液的作用是___________ 。
③粗产品中钒的质量分数表达式为___________ (以VO2计)。
④若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果___________ ( 填“偏高”、“偏低”或“无影响”)。

已知:+4价钒的化合物易被氧化。
回答下列问题:
(1)装置D中盛放NH4HCO3溶液的仪器名称是
(2)实验开始时,先关闭K2,打开K1,当
(3)实验完毕后,从装置D中分离产品的操作方法是
(4)测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用20 mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:
 +Fe2++2H+= VO2++Fe3++H2O)
+Fe2++2H+= VO2++Fe3++H2O)①
 中V的化合价
中V的化合价②过量KMnO4溶液的作用是
③粗产品中钒的质量分数表达式为
④若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果
您最近一年使用:0次
解题方法
5 . 过硫酸钠 常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。
Ⅰ.制备

已知:①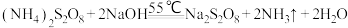
②
③ 是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
回答下列问题:
(1)
 中过氧键的物质的量为
中过氧键的物质的量为___________ ;装置A的名称为___________ ;装置丁的作用是___________ 。
(2)实验时需要将装置甲中反应产生的 持续通入装置丙中,目的是
持续通入装置丙中,目的是___________ 。
(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是___________ 。
Ⅱ.探究 的氧化性
的氧化性
(4)酸性过硫酸钠溶液,在 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。
溶液可以产生白色沉淀。
①用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为___________ 。
②该反应的离子方程式为___________ 。
(5)工业上用 测定废水中氮元素的含量:取
测定废水中氮元素的含量:取 含
含 的废水,用
的废水,用
 标准溶液滴定(氮元素被氧化为
标准溶液滴定(氮元素被氧化为 ,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为
,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为 ,则废水中氮元素的含量为
,则废水中氮元素的含量为___________  (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
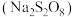 常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。Ⅰ.制备


已知:①
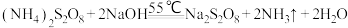
②

③
 是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
是白色晶状粉末,易溶于水,加热至65℃就会发生分解。回答下列问题:
(1)

 中过氧键的物质的量为
中过氧键的物质的量为(2)实验时需要将装置甲中反应产生的
 持续通入装置丙中,目的是
持续通入装置丙中,目的是(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是
Ⅱ.探究
 的氧化性
的氧化性(4)酸性过硫酸钠溶液,在
 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。
溶液可以产生白色沉淀。①用酸性
 溶液检验
溶液检验 时的实验现象为
时的实验现象为②该反应的离子方程式为
(5)工业上用
 测定废水中氮元素的含量:取
测定废水中氮元素的含量:取 含
含 的废水,用
的废水,用
 标准溶液滴定(氮元素被氧化为
标准溶液滴定(氮元素被氧化为 ,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为
,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为 ,则废水中氮元素的含量为
,则废水中氮元素的含量为 (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
您最近一年使用:0次
6 . 硫脲的分子式为CS(NH2)2,其在生产生活中有重要的应用。科研人员在实验室利用Ca(HS)2与CaCN2可以合成硫脲,用下图仪器可制备Ca(HS)2,请回答下列问题。

已知:①CS(NH2)2易溶于水;②CS(NH2)2在150°C时生成NH4SCN;③CS(NH2)2易被强氧化剂氧化。
(1)装盐酸仪器的名称为_______ ,装置A中发生反应的离子方程式为_______ ;
(2)实验结束后从左侧导管通入氮气的目的是_______ ;
(3)装置B中盛装的试剂是_______ ,其作用是_______ ;
(4)当C中出现_______ 现象时,停止反应;
(5)将得到的Ca(HS)2溶液与CaCN2溶液混合,加热一段时间即可生成硫脲,同时生成一种强碱为_______ ;
(6)实验室用KMnO4(H+)溶液滴定硫脲测定其含量,生成N2, 等,则还原剂与氧化剂的物质的量之比
等,则还原剂与氧化剂的物质的量之比_______ ,将硫脲粗产品0.8g,配成1000mL溶液,取100mL,用0.1mol/L酸性高锰酸钾溶液滴定,消耗酸性高锰酸钾溶液28.00mL,粗产品中硫脲的百分含量为_______ (杂质不参加反应)。

已知:①CS(NH2)2易溶于水;②CS(NH2)2在150°C时生成NH4SCN;③CS(NH2)2易被强氧化剂氧化。
(1)装盐酸仪器的名称为
(2)实验结束后从左侧导管通入氮气的目的是
(3)装置B中盛装的试剂是
(4)当C中出现
(5)将得到的Ca(HS)2溶液与CaCN2溶液混合,加热一段时间即可生成硫脲,同时生成一种强碱为
(6)实验室用KMnO4(H+)溶液滴定硫脲测定其含量,生成N2,
 等,则还原剂与氧化剂的物质的量之比
等,则还原剂与氧化剂的物质的量之比
您最近一年使用:0次
7 . 为探究不同价态铜的氧化物对电化学还原CO2产生的影响,某兴趣小组进行以下活动。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为___________ 。
(2)反应控制在0℃,原因是___________ 。
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
①1mg CuO2样品与___________ μL的H2O2溶液还原能力相当
②若CuO2纯度为96%,过氧化氢物质的量浓度约为___________ mol·L−1.(1μL = 10−6L)
③“实验4”中,最终溶液的颜色是___________ 。
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s) 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。
(4)装置D中盛放的试剂为___________ 。
(5)管式炉中CuO2反应的化学方程式为___________ 。
(6)通入氧气的目的是___________ 。
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率( )如下表所示:(
)如下表所示:( =
= )
)
①该条件下,CO2还原产物有___________ 种
②CH4与C2H4物质的量之比为___________ 。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为
(2)反应控制在0℃,原因是
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
| 编号 | m(CuO2)/mg | V(H2O2)/ μL | V(H2SO4)/mL | V(KMnO4)/ μL | 实验结束时溶液的颜色 |
| 1 | - | - | 2 | 10 | 紫色 |
| 2 | 1 | - | 2 | 10 | 浅紫色 |
| 3 | 2 | - | 2 | 10 | 浅紫色 |
| 4 | 4 | - | 2 | 10 | - |
| 5 | - | 10 | 2 | 10 | 浅紫色 |
| 6 | - | 20 | 2 | 10 | 浅紫色 |
| 7 | - | 40 | 2 | 10 | 无色 |
②若CuO2纯度为96%,过氧化氢物质的量浓度约为
③“实验4”中,最终溶液的颜色是
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s)
 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。 (4)装置D中盛放的试剂为
(5)管式炉中CuO2反应的化学方程式为
(6)通入氧气的目的是
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率(
 )如下表所示:(
)如下表所示:( =
= )
)| 阴极产物 | CO | CH4 | C2H4 | H2 |
| 电流效率/% | 5 | 18 | 30 | 15 |
②CH4与C2H4物质的量之比为
您最近一年使用:0次
2023-05-09更新
|
329次组卷
|
2卷引用:福建省龙岩市2023届高中毕业班五月教学质量检测化学试题
2023高三·全国·专题练习
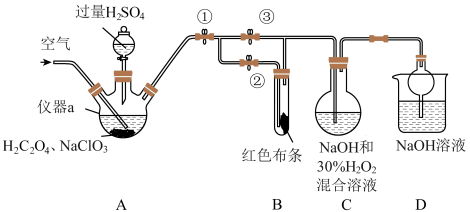
8 .  又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质。
的某些性质。
已知:温度高于 会分解为
会分解为 与
与 。
。
(1)仪器a的名称为_______ 。
(2)装置A用于制备 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成 ,该反应体现了
,该反应体现了 的
的_______ 性。由于生成 的反应放热,为防止
的反应放热,为防止_______ ,所以采用冷水浴。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)城市饮用水处理新技术用 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的_______ 倍(结果保留两位小数)。
 又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质。
的某些性质。
已知:温度高于
 会分解为
会分解为 与
与 。
。(1)仪器a的名称为
(2)装置A用于制备
 ,该反应的化学方程式为
,该反应的化学方程式为(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成
 ,该反应体现了
,该反应体现了 的
的 的反应放热,为防止
的反应放热,为防止(4)城市饮用水处理新技术用
 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
名校
解题方法
9 . 苯甲酸是一种重要的化工产品,在25℃和95℃下在水中的溶解度分别为0.3 g和6.9 g。实验室制备苯甲酸并测定其纯度的步骤如下:
I.苯甲酸的制备
量取一定量的甲苯和足量
 溶液发生反应:
溶液发生反应: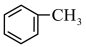 +2KMnO4
+2KMnO4
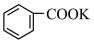 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
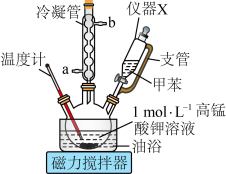
(1)仪器X的名称为_______ ,冷凝管的出水口为_______ (填“a”或“b”)。
(2)三颈烧瓶中反应基本完成的现象为_______ ,用油浴加热的优点是_______ 。
(3)“滤渣”的主要成分为_______ (填化学式);每得到1 mol滤渣,理论上转移的电子的物质的量为_______ mol。
(4)酸化时,_______ (填“能”或“不能”)用冰醋酸代替浓硫酸,理由是_______ 。
II.纯度测定
(5)称取0.10 g样品,溶于15 mL NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为_______ ,若第二次滴定过程中,滴定管起始有气泡,滴定终点时气泡消失,则导致所测得样品中苯甲酸的纯度_______ (填“偏高”、“偏低”或“不变”)。
I.苯甲酸的制备
量取一定量的甲苯和足量

 溶液发生反应:
溶液发生反应: +2KMnO4
+2KMnO4
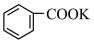 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
(1)仪器X的名称为
(2)三颈烧瓶中反应基本完成的现象为
(3)“滤渣”的主要成分为
(4)酸化时,
II.纯度测定
(5)称取0.10 g样品,溶于15 mL
 NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
您最近一年使用:0次
2023-01-14更新
|
174次组卷
|
3卷引用:河北省邯郸市部分学校2022-2023学年高三上学期期末考试化学试题
名校
解题方法
10 . 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___ ,反应过程中持续通入氮气的目的是__ 。
(2)(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:__ 。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:__ 。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
①在___ (填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为__ ;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为__ g(用含V1的代数式表示,5H2O2~2MnO )。
)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)图中装有NaOH溶液的仪器的名称为
(2)(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
②若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
 )。
)。
您最近一年使用:0次



