名校
1 . i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
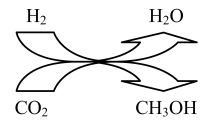
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成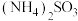 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
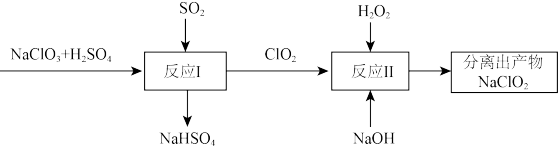
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成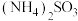 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2022-10-12更新
|
528次组卷
|
3卷引用:辽宁省实验中学2022-2023学年高一上学期10月月考化学试题
名校
解题方法
2 . 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
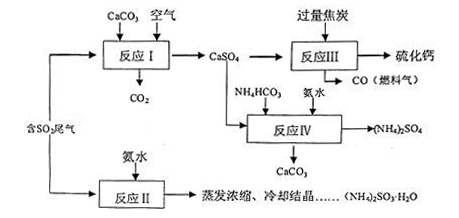
(1)写出反应Ⅰ的化学方程式________________________ .
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________ ;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________ .
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________ .
(4)根据合成流程,可以循环利用的是____________ .
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________ .

(1)写出反应Ⅰ的化学方程式
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有
(4)根据合成流程,可以循环利用的是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式
您最近一年使用:0次
2017-02-28更新
|
302次组卷
|
4卷引用:河南省南阳市2020届高三上学期期中质量评估化学试题
河南省南阳市2020届高三上学期期中质量评估化学试题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训陕西省西安市第一中学2021届高三上学期第五次模拟考试化学试题2016-2017学年辽宁省六校协作体高二下学期期初化学试卷
3 . 化学在“三废”治理方面发挥着重要的作用。回答下列问题:
Ⅰ.制革厂含硫废水中主要含有 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。
(1) 的电子式为
的电子式为___________ ;
(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式___________ 。
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为___________ 。
Ⅱ.工业上用烟气制酸的废料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
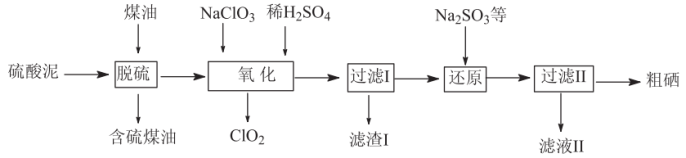
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是___________ 。
(5)“脱硫”过程中,温度控制在95℃,原因是___________ 。
(6)“氧化”过程中,Se转化成弱酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
Ⅲ.粗硒经过下列流程可获得亚硒酸钠( )。
)。
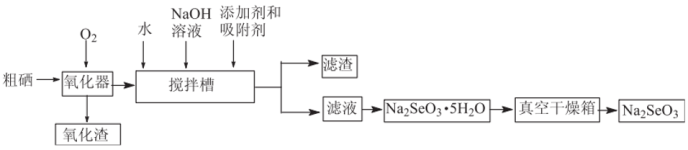
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产___________ t(精确到0.01t)含亚硒酸钠95%的产品。
Ⅰ.制革厂含硫废水中主要含有
 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。(1)
 的电子式为
的电子式为(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的
 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为Ⅱ.工业上用烟气制酸的废料(主要含S、Se、
 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是
(5)“脱硫”过程中,温度控制在95℃,原因是
(6)“氧化”过程中,Se转化成弱酸
 ,该反应的离子方程式为
,该反应的离子方程式为Ⅲ.粗硒经过下列流程可获得亚硒酸钠(
 )。
)。
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产
您最近一年使用:0次
名校
解题方法
4 . 抗溃疡药奥美拉唑合成路线如下:
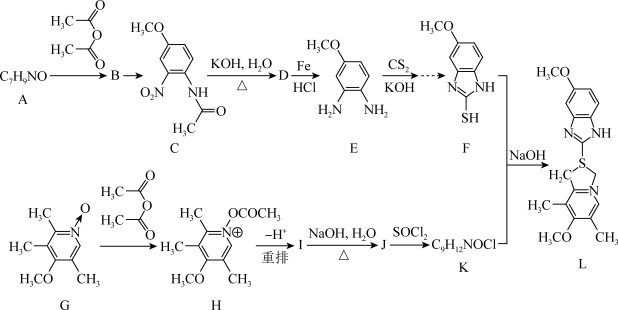
已知: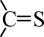 的某些性质和
的某些性质和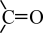 相似,都能与
相似,都能与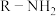 发生加成。
发生加成。
(1)请写出A的结构简式为_______ 。
(2)写出符合下列条件的A的同分异构体M的结构简式:_______ 。
①遇氯化铁溶液显紫色
②1mol M最多能与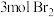 发生取代反应产生白色沉淀
发生取代反应产生白色沉淀
③核磁共振氢谱有6组峰,峰面积之比为1∶1∶2∶1∶3∶1
(3)B→C的反应试剂及条件是_______ 。
(4)C→D的化学方程式是_______ 。
(5)D→E过程中,氧化剂与还原剂的物质的量之比为_______ 。
(6)J的分子式为 ,则I的结构简式是
,则I的结构简式是_______ 。
(7)E经三步反应形成F,请写出中间体1和中间体2的结构简式_______ 、_______ 。
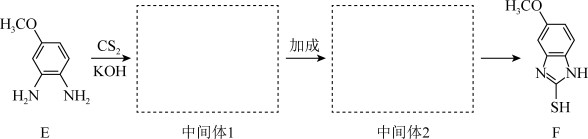

已知:
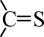 的某些性质和
的某些性质和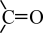 相似,都能与
相似,都能与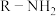 发生加成。
发生加成。(1)请写出A的结构简式为
(2)写出符合下列条件的A的同分异构体M的结构简式:
①遇氯化铁溶液显紫色
②1mol M最多能与
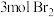 发生取代反应产生白色沉淀
发生取代反应产生白色沉淀③核磁共振氢谱有6组峰,峰面积之比为1∶1∶2∶1∶3∶1
(3)B→C的反应试剂及条件是
(4)C→D的化学方程式是
(5)D→E过程中,氧化剂与还原剂的物质的量之比为
(6)J的分子式为
 ,则I的结构简式是
,则I的结构简式是(7)E经三步反应形成F,请写出中间体1和中间体2的结构简式

您最近一年使用:0次
名校
解题方法
5 . 碳酸锰(MnCO3)是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质)制取碳酸锰的流程如图所示:

其中,还原焙烧主反应为2MnO2+C 2MnO+CO2↑。根据要求回答问题:
2MnO+CO2↑。根据要求回答问题:
(1)若在实验室中进行步骤A,则需用到的仪器为___________ 。步骤B中为了加快浸取的速率,可以采取的措施是___________ (填写两条即可)。
(2)步骤C中得到的滤渣的成分是___________ 。步骤D中氧化剂与还原剂的物质的量之比为___________ 。
(3)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。

①MnO
___________ (填“能”或“不能”)稳定存在于pH=0的溶液中。
②将Mn3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为___________
(4)步骤H的离子方程式为___________ 。实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全:2Mn2++5S2O +8H2O=16H++10SO
+8H2O=16H++10SO +2MnO
+2MnO ,确认Mn2+已完全反应的现象是
,确认Mn2+已完全反应的现象是___________ 。检验时必须控制Mn2+的浓度不能过大,否则实验失败。理由是___________ 。

其中,还原焙烧主反应为2MnO2+C
 2MnO+CO2↑。根据要求回答问题:
2MnO+CO2↑。根据要求回答问题:(1)若在实验室中进行步骤A,则需用到的仪器为
(2)步骤C中得到的滤渣的成分是
(3)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。

①MnO

②将Mn3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为
(4)步骤H的离子方程式为
 +8H2O=16H++10SO
+8H2O=16H++10SO +2MnO
+2MnO ,确认Mn2+已完全反应的现象是
,确认Mn2+已完全反应的现象是
您最近一年使用:0次
名校
6 . 氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
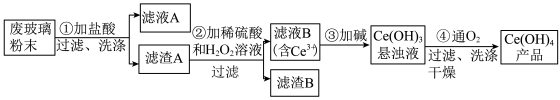
下列说法错误的是

下列说法错误的是
| A.滤渣A中主要含有SiO2、CeO2 |
| B.过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒 |
| C.过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑ |
| D.过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023 |
您最近一年使用:0次
2019-05-31更新
|
1861次组卷
|
12卷引用:【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题
【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)【新东方】 2020-17四川省成都市实验中学2020届高考化学模拟试卷(二)河南省商丘市第一高级中学2021-2022学年高一上学期期末考试化学试题河南省南阳市2021-2022学年高一下学期期终质量评估化学试题 陕西省安康中学2023届高三第一次检测性考试化学试题湖北省麻城市实验高级中学2021-2022学年高三下学期第一次联考化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)山东省滕州市第一中学2022-2023学年高一下学期6月月考化学试题天津市第四十七中学2023-2024学年高三上学期第一次阶段性检测化学试题
名校
解题方法
7 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: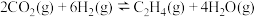
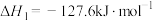
反应ii: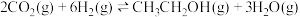
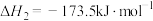
反应iii: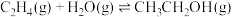
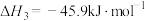
请回答下列问题:
(1)已知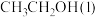 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示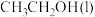 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和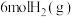 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如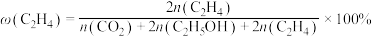 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,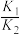
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(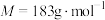 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
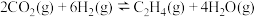
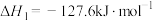
反应ii:
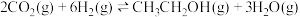
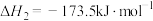
反应iii:
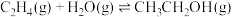
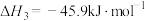
请回答下列问题:
(1)已知
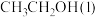 的燃烧热(
的燃烧热( )为
)为 ,表示
,表示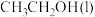 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和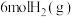 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如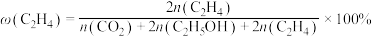 ]与时间的关系如图所示。
]与时间的关系如图所示。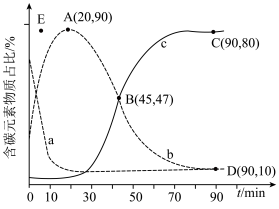
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,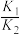
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)( )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。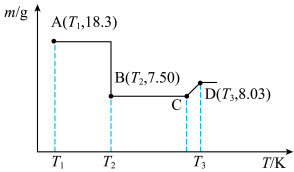
您最近一年使用:0次
8 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以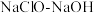 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(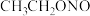 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以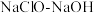 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(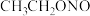 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入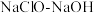 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成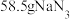 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
名校
解题方法
9 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
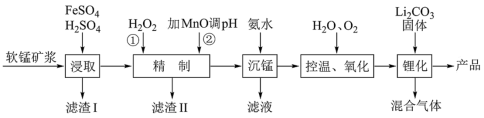
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为______ 。
(2)滤渣II的主要成分是______ ;“精制”中加入H2O2的量比理论值大得多,其主要原因是_____ 。
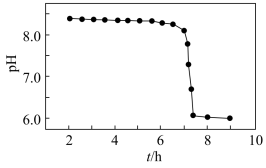
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是______ (用化学方程式表示)。
(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为______ 。
(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是_____ 。
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy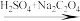 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为______ 。

(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)滤渣II的主要成分是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为
 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy
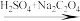 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
您最近一年使用:0次
2023-01-10更新
|
598次组卷
|
3卷引用:山东省烟台第一中学2022-2023学年高一上学期月考化学试题
10 . 钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型__________ 。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________ 。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________ 。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________ 。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________ 。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________ 。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________ 。
(1)钒酸盐与磷酸盐结构相似。请画出VO
 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下
| 配离子 |  |
| [Fe(edta)]2- [Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ | 2.1×1014 1.7×1024 2.0×1021 1.3×1014 |
| 沉淀 | Ksp |
| Fe(OH)2 Fe(OH)3 | 8.0×10-16 4.0×10-38 |
您最近一年使用:0次



