名校
解题方法
1 . 分类思想是化学学科学习与研究的一种极为重要的思维方式。回答下列向题:
(1)有如下几种物质: 、
、 、
、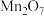 、
、 、
、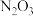 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成________ (填“二”或“三”)类,写出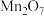 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为________ (填相互关系)。白磷有剧毒,硫酸铜可作为白磷中毒的解毒剂,请配平相应的化学方程式:________
____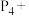 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是________ (填字母)。
A. 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐
C.均具有较强的还原性 D. 是三元弱酸
是三元弱酸
(1)有如下几种物质:
 、
、 、
、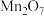 、
、 、
、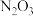 五种成盐氧化物,按化学性质可将它们分成
五种成盐氧化物,按化学性质可将它们分成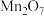 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:(2)磷能形成多种具有独特性质的物质。
①如磷能形成红磷、白磷、黑磷等多种单质,它们互为
____
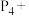 ______
______ _____
_____ _____
_____ ____
____ _____
_____
②磷的一种组成为
 的盐,能与盐酸反应,但不能与
的盐,能与盐酸反应,但不能与 溶液反应,下列有关
溶液反应,下列有关 、
、 的分析中正确的是
的分析中正确的是A.
 是酸式盐 B.
是酸式盐 B. 是正盐
是正盐C.均具有较强的还原性 D.
 是三元弱酸
是三元弱酸
您最近一年使用:0次
2023-11-13更新
|
278次组卷
|
2卷引用:吉林省吉林市第一中学2023--2024学年高一上学期第一次月考化学试题(创新班)
2 . 写出下列反应的离子方程式(已知还原性: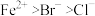 ):
):
(1)向 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):_________ ;
(2)向 溶液中通入足量
溶液中通入足量 :
:______ ;
(3)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:______ 。
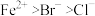 ):
):(1)向
 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):(2)向
 溶液中通入足量
溶液中通入足量 :
:(3)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:
您最近一年使用:0次
2020-10-01更新
|
1459次组卷
|
3卷引用:吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题
真题
名校
3 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________ 、_______________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
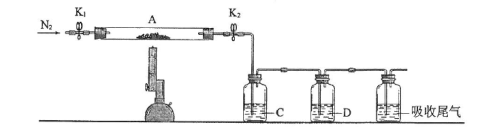
①C、D中的溶液依次为_________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2017-08-08更新
|
9166次组卷
|
30卷引用:吉林省延边市第二中学2020届高三入学考试化学试题
吉林省延边市第二中学2020届高三入学考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题四川省双流中学2017-2018学年高二上学期开学考试化学试题江西省上高二中2018届高三上学期第三次月考化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密百所名校联考-金属及其化合物安徽省黄山市屯溪第一中学2019-2020学年高二上学期入学摸底考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2020届高考化学二轮复习大题精准训练——化学实验方案的设计及评价河北省衡水中学2020届高三四月份质量监测理综化学试题湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮福建省福州市第二中学2021届高三上学期第一次月考化学试题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物云南省保山第九中学2021届高三上学期开学考试化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型31 Fe2+、Fe3+的检验与性质探究
名校
4 . 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
(1)固体I中主要成分为__________ ,捕获剂所捕获的气体主要是_________ 。
(2)处理含NH4+废水时,发生反应的离子方程式为___________ 。
(3)若X为适量空气,严格控制空气用量的原因是____________ 。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________ 。增加压强,NO的转化率__________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________ 。
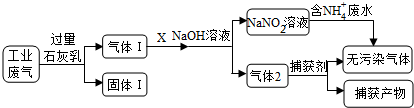
(1)固体I中主要成分为
(2)处理含NH4+废水时,发生反应的离子方程式为
(3)若X为适量空气,严格控制空气用量的原因是
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
2017-03-19更新
|
483次组卷
|
2卷引用:2017届吉林省长白山市高三第二次模拟考试理综化学试卷



