名校
1 . 二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: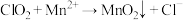 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: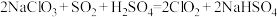 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
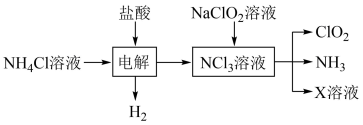
已知: 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法不 正确的是
 )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: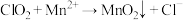 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: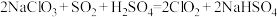 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
已知:
 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B.电解池中总反应的化学方程式为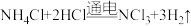 |
C.X溶液中主要存在的离子有: 、 、 、 、 |
D.饮用水制备过程中残留的 可用适量 可用适量 溶液去除 溶液去除 |
您最近一年使用:0次
2021-11-19更新
|
1325次组卷
|
4卷引用:第二章 分子结构与性质(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
19-20高三·山东潍坊·阶段练习
2 . A、B、C、D是原子序数依次递增的四种短周期元素。基态A原子所含的电子只有一种运动状态;基态B原子中有三个未成对电子。A、B、C、D四种元素共同组成化合物M,M可发生如下反应:
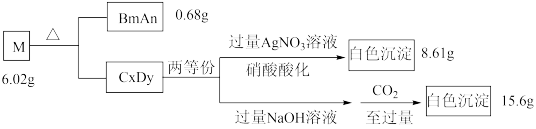
回答下列问题:
(1)B原子的价电子排布式为_______ 。实验室制备BmAn的化学方程式是_________ 。
(2)A、C、D三种元素的原子半径由大到小的顺序为_________ (用元素符号表示)。
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是____________ 。
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为_________ 。
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为_____ mol;若产生的“气泡”与DO2的物质的量相等,则反应过程中消耗NaDO2、NaHSO4、NaHCO3的物质的量之比为____________ 。
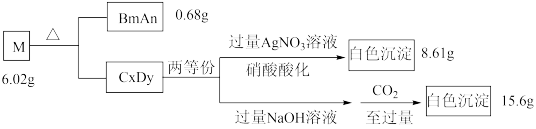
回答下列问题:
(1)B原子的价电子排布式为
(2)A、C、D三种元素的原子半径由大到小的顺序为
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为
您最近一年使用:0次
3 . CuS、Cu2S用于处理酸性废水中的Cr2O72-反应如下。
反应I:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
下列有关说法正确的是
反应I:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平)
下列有关说法正确的是
| A.反应I和Ⅱ中各有2种元素的化合价发生变化 |
| B.处理1molCr2O72-时反应I、Ⅱ中消耗H+的物质的量相等 |
| C.反应Ⅱ中还原剂与氧化剂的物质的量之比为3:5 |
| D.质量相同时,Cu2S能去除更多的Cr2O72- |
您最近一年使用:0次
2019-02-25更新
|
541次组卷
|
4卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题3
沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题3【市级联考】山东省济南市2019届高三上学期期末考试化学试题(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》
名校
4 . 往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法正确的是
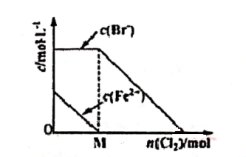

| A.当n(Cl2)<M mol时,发生的离子反应:2Br-+Cl2=Br2+2Cl- |
| B.当n(Cl2)=M mol时,离子浓度关系:c(Fe3+):c(Br-):c(Cl-)=2:1:1 |
| C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-) |
| D.当Br-开始被氧化时,通入Cl2的物质的量大于原FeBr2的物质的量 |
您最近一年使用:0次
2019-01-21更新
|
490次组卷
|
2卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2
名校
解题方法
5 . 前一时期“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
| A.ClO2的分子结构呈V形,属非极性分子 |
| B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 |
| C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 |
| D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O |
您最近一年使用:0次
2016-12-09更新
|
1115次组卷
|
4卷引用:宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2
宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2云南省西双版纳州民族中学2017-2018学年高二6月份考试化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题(已下线)2012届河北省唐山一中高三上学期期中考试化学试卷



