12-13高一上·浙江宁波·期中
名校
解题方法
1 . NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,在该反应中H2O
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
您最近一年使用:0次
2021-10-05更新
|
900次组卷
|
14卷引用:【新东方】2019新中心五地018高中化学
(已下线)【新东方】2019新中心五地018高中化学(已下线)2011-2012年浙江宁波万里国际中学高一第一学期期中考试化学试卷浙江省名校新高考研究联盟(Z20联盟)2020届高三第三次联考化学试题浙江省北斗联盟2020-2021学年高二上学期期中联考化学试题(已下线)3.1.3 氧化还原反应(1)(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)(已下线)2011-2012学年山东省莘县实验高中高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省庆安三中高一上学期期末考试化学试卷2015-2016学年贵州省乌当区新天学校高二上学期期中测试化学试卷河北省邯郸市大名一中2019-2020学年高一上学期第二次月考化学试题河北省大名县第一中学2019-2020学年高一12月月考(普通班)化学试题甘肃省天水市田家炳中学2021-2022学年高一上学期第一阶段考试化学试卷河南省周口恒大中学2021-2022学年高一上学期第一次月考化学试题云南省昆明市第八中学2021-2022学年高一上学期期中考试化学试题山西省灵丘县第四中学校2021-2022学年高一上学期期中考试化学试题
21-22高三上·浙江·开学考试
解题方法
2 . O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法不正确的是
| A.氧气是还原产物 |
| B.O2F2是氧化剂 |
| C.还原剂与氧化剂的物质的量之比为1:4 |
| D.若生成448LHF,则转移0.8mol电子 |
您最近一年使用:0次
2021-09-04更新
|
357次组卷
|
3卷引用:解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省 山水联盟 2022届高三上学期开学联考化学试题重庆市缙云联盟2021-2022学年高一10月质量检测化学试题
21-22高三上·浙江·开学考试
3 . 关于化合物 的性质,下列推测不合理的是
的性质,下列推测不合理的是
 的性质,下列推测不合理的是
的性质,下列推测不合理的是| A.具有强还原性 |
| B.不能与氨气发生反应 |
C.可发生反应: |
D.实验室可用 与 与 共热来制备 共热来制备 |
您最近一年使用:0次
2021·北京东城·一模
名校
解题方法
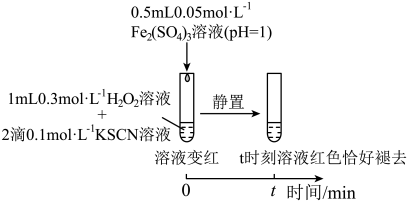
4 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
实验III:
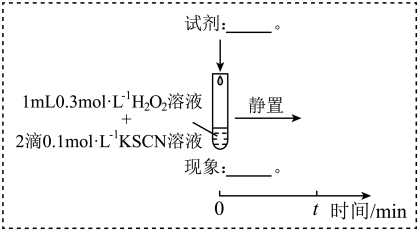
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
633次组卷
|
7卷引用:考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
2021·辽宁沈阳·一模
名校
解题方法
5 . 某些氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4、2Na2O2+2SO3(g)= 2Na2SO4+O2。据此判断下列反应方程式错误的是
| A.2Na2O2+2N2O3=4NaNO2+O2 | B.Na2O2+2NO2=2NaNO3 |
| C.2Na2O2+2N2O5═4NaNO3+O2 | D.2Na2O2+2Mn2O7=4NaMnO4+O2 |
您最近一年使用:0次
2021-08-09更新
|
962次组卷
|
13卷引用:考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第07讲 钠及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)辽宁省沈阳市2021届高三教学质量监测(一)化学试题江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题辽宁省沈阳市一二零中学2021-2022学年高三上学期教学质量检测一化学试题天津市第二十中学2022-2023学年高一上学期第二次统练化学试题辽宁省辽东教学共同体2023-2024学年高一上学期10月联考化学试题
10-11高三上·黑龙江·期末
名校
解题方法
6 . 已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
您最近一年使用:0次
2021-07-27更新
|
6118次组卷
|
168卷引用:考点05 氧化还原反应——备战2019年浙江新高考化学考点
(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)【新东方】化学巩固练习34(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)【新东方】化学出门测12342015-2016学年浙江乐成寄宿中学高一下3月月考化学试卷浙江省定海一中2017-2018学年高一第一学期期中考试化学试卷(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】(已下线)2018年10月7日 《每日一题》人教必修1-每周一测(已下线)2019年10月6日《每日一题》必修1 —— 每周一测(已下线)【新东方】高中化学5004(已下线)第08讲 氧化还原反应的基本概念和规律(精讲)——2021年高考化学一轮复习讲练测(已下线)【浙江新东方】绍兴qw81(已下线)【浙江新东方】在线化学20(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00145】(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】(已下线)第06讲 氧化还原反应(精讲)-2022年一轮复习讲练测(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)浙江省台州市七校联盟2020-2021学年高一上学期期中联考化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)浙江省台州市路桥中学2023-2024学年高一上学期10月月考化学试题浙江省台州市第一中学2022-2023学年高一上学期11月期中考试化学试题浙江省杭州市西湖高级中学2023-2024学年高一上学期10月月考化学试题(已下线)2010年黑龙江“五校联谊”高一上学期期末考试化学卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2012届山东省微山一中高三第二次质量检测化学试卷(已下线)2012届辽宁省沈阳四校协作体高三上学期12月月考化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷(已下线)2011-2012学年北京四中高一上学期期中考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2012年鲁科版高中化学必修1 3.4海水中的化学元素练习卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷(已下线)2013-2014学年安徽省安庆一中高一上学期期中考试化学试卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2015-2016学年山西省怀仁一中高一12月月考化学试卷2015-2016学年福建省福州八中高一上学期期末化学试卷2015-2016学年湖北省保康一中高一下第一次月考化学试卷2016-2017学年广东省普宁一中高二上第二次月考化学试卷2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷2016-2017学年山西省怀仁一中高一上月考三化学卷河南省南阳市2016-2017学年高一上学期期终质量评估化学试题2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷山西省忻州市第一中学2016-2017学年必修一:化学物质及其变化同步练习化学试题贵州省大方县第一中学2018届高三上学期第一次月考化学试题湖南省醴陵二中、醴陵四中2017-2018学年高一上学期期中联考化学试题辽宁省六校协作体2017-2018学年高一上学期期中考试化学试卷山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题辽宁省沈阳铁路实验中学2017-2018学年高一上学期期中考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题2山西省临汾第一中学2017-2018学年高一上学期第二次调研(期中)考试化学试题河北省石家庄市第二中学2017-2018学年高一12月月考化学试题甘肃省武威市第六中学2017-2018学年高一上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题3甘肃省嘉峪关市酒钢三中2017-2018学年高一上学期第二次月考化学试题河南省周口市2017-2018学年高一上学期期末考试 化学内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题山东省德州市武城县第二中学2019届高三9月月考化学试题陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期期中考试化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高一上学期期中考试化学试题河南省安阳市第二中学2018-2019学年高一上学期期中考试化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题步步为赢 高二化学暑假作业:作业三 氧化还原反应湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习陕西省西安中学2020届高三上学期第一次月考化学试题上海中学2017-2018学年高一(上)期中化学试卷吉林省油田第十一中学2020届高三上学期第一次阶段考试化学试题上海市宝山中学2017-2018学年高三第一学期期中考化学试题天津市南开中学滨海生态城学校2019-2020高一上学期期中考试化学试题甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题河北省唐山市第一中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市玉溪一中2019-2020学年高一上学期期中考试化学试题吉林省延边第二中学2019-2020学年高一上学期期中考试化学试题山东省微山县第二中学2019-2020学年高一上学期第二学段质量检测化学试题黑龙江省鹤岗市第一中学2019-2020学年高一12月月考化学试题江西省抚州市临川区第二中学2019-2020学年高一上学期第二次月考化学试题云南师范大学附属中学2019-2020学年高一上学期期中考试化学试题云南省金平县第一中学2019-2020学年高一上学期期末考试化学试题新疆沙湾一中2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷云南省昭通市水富县第二中学2019-2020学年高一上学期期末考试化学试题重庆市云阳县江口中学2019-2020学年高一上学期第二次月考化学试题云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题湖南师大附中2019-2020学年高一上期期末考试化学试题安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题四川省攀枝花市第十五中学2019-2020学年高一下学期第二次月考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题四川省凉山州2019-2020学年高二下学期期末检测化学(理)试题(已下线)2.3.2 氧化还原反应的应用 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)辽宁省沈阳市郊联体2019-2020学年高二下学期期末考试化学试题湖南师范大学附属中学2019-2020学年高一上学期期末考试化学试题(已下线)专题04 氧化还原反应(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学苏教版(2020)高一必修第一册专题3第三单元 海洋化学资源的综合利用河南省平顶山市舞钢市第一高级中学2021届高三9月月考化学试题江西省九江市第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高一必修第一册第二章易错疑难集训(二)(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 教材帮上海市2019-2020学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第一次月考化学试题北京中国人民大学附属中学2020-2021学年高一上学期第一次检测化学试题吉林省(长春市)榆树市第一高级中学2021届高三10月月考化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第二次月考化学试题安徽省合肥一中2020-2021学年高一上学期第一次段考化学试题高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物1福建省厦门市湖滨中学2021届高三10月月考化学试题高一必修第一册(苏教2019) 模块综合测评甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高一上学期月考化学试题安徽省蚌埠第三中学2019-2020学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题天津市河东区第八中学2021届高三上学期期中化学试题(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)第3课时 氧化还原反应的基本规律和配平(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)山东省济宁市实验中学2022届高三上学期开学考试化学试题甘肃省静宁县第一中学2022届高三上学期第一次月考化学试题(已下线)3.1.3 氧化还原反应-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题黑龙江省大庆实验中学2021-2022学年高一上学期10月月考化学试题黑龙江省哈尔滨市德强高级中学2021-2022学年高一上学期10月月考化学试题天津市南开中学2021-2022学年高一上学期期中考试化学试题重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题(已下线)第07练 氧化还原反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)上海市崇明区民本中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题贵州省毕节市第一中学2021-2022学年高一上学期第二次阶段性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题四川省凉山州西昌天立中学2021-2022学年高二下学期5月月考化学试题天津市北辰区2022-2023学年高三上学期第一次联考化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题陕西省西安市陕西师范大学附属中学2020-2021学年高一上学期期中考试化学试题陕西省西安中学2022-2023学年高一上学期期中考试化学试题湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高一上学期期末考试化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题重庆市育才中学2021-2022学年高一上学期期中考试化学试题北京市中国人民大学附属中学2020-2021学年高一下学期第一次检测化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题甘肃省嘉峪关市等3地2022-2023学年高一上学期12月期中考试化学试题广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题微专题(二)——氧化还原反应的简单规律及应用重庆市大足中学2022-2023学年高一上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高一上学期开学考试化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题辽宁省大连市瓦房店市高级中学2022-2023学年高一上学期期中考试化学试卷 天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题天津市实验中学滨海学校2023-2024学年高一上学期期中质量调查化学试题
7 . 已知 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,且还原性:
,且还原性: 。下列反应在水溶液中不可能发生的是
。下列反应在水溶液中不可能发生的是
 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,且还原性:
,且还原性: 。下列反应在水溶液中不可能发生的是
。下列反应在水溶液中不可能发生的是A.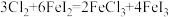 | B.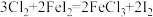 |
C.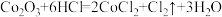 | D. |
您最近一年使用:0次
2021-07-18更新
|
5272次组卷
|
83卷引用:考点05 氧化还原反应——备战2019年浙江新高考化学考点
(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】浙江省台州市书生中学2018-2019学年高一上学期第三次月考化学试题浙江省宁波市北仑中学2019-2020学年高一上学期期中考试化学(2-10班)试题2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)四川省南充市阆中中学2020届高三化学选择题专项训练(12)浙江省诸暨中学2020-2021学年高一上学期10月阶段性考试化学(实验班)试题(已下线)【浙江新东方】36浙江省浙南名校联盟2022-2023学年高一上学期11月期中考试化学试题浙江省杭州市西湖高级中学2023-2024学年高一上学期10月月考化学试题(已下线)09-10学年莘县二中下学期高二期末考试化学卷(已下线)2011届辽宁省丹东市四校协作体第二次联考高三化学试卷(已下线)2012届河北省定州二中高三第一次月考化学试卷(已下线)2012届江西省井冈山市高三上学期联考化学试卷(已下线)2011-2012学年湖北省武汉市东湖中学高一上学期期中联考化学试卷(已下线)2013届江苏省兴化市板桥高级中学高三9月双休检测化学试卷(已下线)2013届江苏省兴化市板桥高级中学高三9月双休检测化学试卷(已下线)2015届黑龙江省双鸭山市第一中学高一上学期期中考试化学试卷2016届辽宁省师范大学附属中学高三10月月考化学试卷2016届吉林省扶余市第一中学高三上学期第一次月考化学试卷2015-2016学年河南省信阳高级中学高一下开学测化学试卷2017届湖南省石门一中高三上学期9月月考化学试卷2017届河北省沧州一中高三上学期9.22周测化学卷2017届陕西省西安市第七十中学高三上学期10月月考化学试卷2016-2017学年河北省定州市高一上学期期中化学试卷【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期期末考试(理)化学试题【全国校级联考】贵州省铜仁市西片区高中教育联盟2017-2018学年高二下学期期末考试化学试题(已下线)【走进新高考】(人教版必修一)2.3.2 氧化还原反应——氧化剂和还原剂 同步练习02【全国百强校】黑龙江省哈尔滨市第三中学2018-2019学年高一上学期期末考试化学试题步步为赢 高二化学暑假作业:作业三 氧化还原反应安徽省合肥市五校2017-2018学年高一下学期期末联考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)内蒙古额市一中2019-2020学年高一第一学期期中化学试题云南省富宁县第一中学2020届高三第一学期开学考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期期中考试化学试题甘肃省张掖市第二中学2019-2020学年高一上学期期中考试化学试题湖北省荆州市沙市中学高一化学第二章化学物质及其变化过关训练13(已下线)上海市徐汇区2010届高三第二次模拟考试化学试题(已下线)【南昌新东方】莲塘二中 2019-2020 高一(上)期末河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题甘肃省兰州师范大学附属中学2019-2020学年高一上学期期中考试化学试题广东省中山市桂山中学2018-2019学年高一上学期期中考试化学试题(已下线)衔接点07 氧化剂和还原剂-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)1.3.2 氧化剂和还原剂(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)鲁科版(2019)高一必修第一册第二章第3节 氧化还原反应 课时2 氧化剂和还原剂氧化还原反应的应用(已下线)第二章 化学物质及其变化(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)高一必修第一册(鲁科2019)第2章第3节 氧化还原反应 方法帮江西省南昌市南昌县莲塘第二中学2019-2020学年高一上学期期末考试化学试题湖南省益阳市箴言中学2020-2021学年高一上学期第一次月考化学试题人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 方法帮湖南省长沙市周南中学2020-2021学年高一上学期第一次月考化学试题天津市耀华中学2020-2021学年高一上学期第一次月考化学试题湖南省常德市一中2020-2021学年高一上学期10月月考化学试题(已下线)2.3.2 氧化剂和还原剂(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题山东省日照第一中学2021届高三上学期10月份第一次调研考试化学试题甘肃省武威市民勤县第一中学2019-2020学年高一下学期期中考试化学(文) 试题安徽省六安市第一中学2020-2021学年高一上学期第一次段考化学试题广东省东莞市粤华学校2019-2020学年高一上学期期中考试化学试题四川省南充市西充中学2020-2021学年高一上学期9月月考化学试题江西省赣州市南康中学2020-2021学年高一上学期第三次大考化学试题云南省玉溪市2020-2021学年高一下学期期末教学质量检测化学试题(已下线)周末培优1 离子反应的应用 氧化还原反应基本规律-2021-2022学年高一化学课后培优练(人教版2019必修第一册)第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)吉林省长春外国语学校2019-2020学年高二下学期期末考试化学(理)试题(已下线)必考点05 氧化还原反应的规律及综合判断-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)江西省奉新县部分学校2021-2022学年高一上学期第二次月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高一上学期第二次月考化学试题山西省河津市第二中学2022-2023学年高一上学期9月月考 化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高一上学期9月月考化学试题辽宁省沈阳市辽中区第二高级中学2022-2023学年高一上学期10月月考化学试题湖北省武汉市水果湖高中2022-2023学年高一上学期10月月考化学试题山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题上海高考2017届压轴卷 化学试题江西省宜春市丰城第九中学日新部2022-2023学年高一上学期期末化学试题天津市耀华中学2023-2024学年高一上学期第一次月考化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题安徽省阜阳市第三中学2023-2024学年高一上学期10月月考化学试题东北育才学校双语校区2023-2024学年高一上学期化学学科10月自主测评试题安徽省安庆市安庆七中2023-2024学年高一上学期期中考试化学试卷
2021·浙江·模拟预测
名校
解题方法
8 . 火法炼铜中涉及反应:2CuFeS2+O2 Cu2S+2FeS+SO2,下列判断正确的是
Cu2S+2FeS+SO2,下列判断正确的是
 Cu2S+2FeS+SO2,下列判断正确的是
Cu2S+2FeS+SO2,下列判断正确的是| A.CuFeS2只作还原剂 |
| B.SO2既是氧化产物又是还原产物 |
| C.消耗1 mol O2时转移电子的物质的量为4 mol |
| D.每生成1 mol Cu2S同时产生22.4 LSO2 |
您最近一年使用:0次
2021-06-30更新
|
705次组卷
|
7卷引用:考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)浙江省北斗星盟2021届高三下学期5月适应性联考化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)江苏省盐城市伍佑中学2022届高三上学期期初调研考试化学试题江西省九校2021-2022学年高三上学期期中联考化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题
20-21高一下·黑龙江哈尔滨·阶段练习
解题方法
9 . 工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
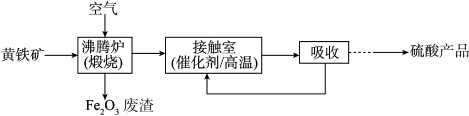
(1)沸腾炉中发生反应的化学方程式为4FeS2+11O2 2Fe2O3+8SO2,该反应被氧化的元素是
2Fe2O3+8SO2,该反应被氧化的元素是_______ (填元素名称)。
(2)利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为_______ 。
(3)从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:_______ 。
(4)有些反应中物质浓度不同,性质也不同。浓硫酸有三大特性:吸水性、脱水性、强氧化性。则加热时浓硫酸与木炭反应的化学方程式为_______ 。
(5)将一定量锌与100mL18mol/L浓硫酸充分反应后,若锌完全溶解同时产生气体0.8mol,将反应后的溶液稀释得400mL,测得c(H+)=2mol/L,则产生气体中SO2物质的量为_______ mol。

(1)沸腾炉中发生反应的化学方程式为4FeS2+11O2
 2Fe2O3+8SO2,该反应被氧化的元素是
2Fe2O3+8SO2,该反应被氧化的元素是(2)利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为
(3)从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:
(4)有些反应中物质浓度不同,性质也不同。浓硫酸有三大特性:吸水性、脱水性、强氧化性。则加热时浓硫酸与木炭反应的化学方程式为
(5)将一定量锌与100mL18mol/L浓硫酸充分反应后,若锌完全溶解同时产生气体0.8mol,将反应后的溶液稀释得400mL,测得c(H+)=2mol/L,则产生气体中SO2物质的量为
您最近一年使用:0次
20-21高一下·山西太原·阶段练习
名校
10 . 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应,下列说法错误的是


| A.溶液B中发生的反应为2SO2+O2=2SO3 |
| B.可用硫氰化钾(KSCN)溶液检验溶液C中是否含有Fe3+ |
C.由以上流程可推知氧化性:O2>Fe3+>SO |
| D.能循环利用的物质Fe2(SO4)3 |
您最近一年使用:0次
2021-06-01更新
|
730次组卷
|
6卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省太原市第五十六中学2020-2021学年高一下学期5月月考化学试题天津市武清区杨村第一中学2022-2023学年高三上学期第一次月考化学试题陕西省西安中学2023-2024学年高三上学期8月月考化学试题



