23-24高三上·江西上饶·阶段练习
名校
解题方法
1 . 下列反应的离子方程式书写正确的是
A.将 加入足量的稀盐酸中: 加入足量的稀盐酸中: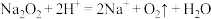 |
B.向 溶液中通入足量氯气: 溶液中通入足量氯气: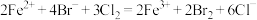 |
C.铜单质与 溶液在酸性条件下反应转化为盐: 溶液在酸性条件下反应转化为盐: |
D.氯化铝溶液中加入过量氨水: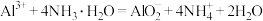 |
您最近一年使用:0次
23-24高三上·辽宁沈阳·阶段练习
解题方法
2 . 下列反应的离子方程式书写正确的是
A.将少量氯气通入 溶液中: 溶液中: |
B.将少量 溶液滴入 溶液滴入 溶液中: 溶液中: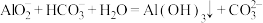 |
C.海带灰浸出液中滴加几滴硫酸酸化的过氧化氢溶液: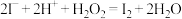 |
D.Cu溶于稀硝酸: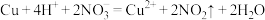 |
您最近一年使用:0次
23-24高三上·北京海淀·阶段练习
名校
解题方法
3 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料
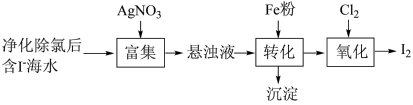
下列说法错误的是
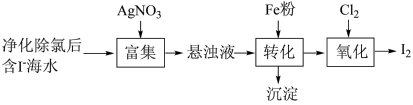
下列说法错误的是
| A.“富集”是为了提高I—的浓度 |
| B.“转化”过程中铁粉被氧化 |
| C.“氧化”通入氯气越多越好 |
| D.“氧化”主要发生的离子反应为:Cl2+2I-=2Cl-+I2 |
您最近一年使用:0次
22-23高三上·黑龙江鹤岗·阶段练习
名校
解题方法
4 . 下列离子在指定的分散系中能够大量共存的是
A.铁与过量稀硝酸反应后的溶液中: 、 、 、 、 、 、 |
B.通入大量 的溶液中: 的溶液中: 、 、 、 、 、 、 |
C.常温下, 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D. 溶液中: 溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
23-24高三上·河南洛阳·开学考试
名校
解题方法
5 . 物质的性质决定用途,下列有关物质性质与用途均正确且两者具有对应关系的是
| A.晶体硅熔点高、硬度大,可用于制作半导体材料 |
B. 具有还原性,可用作葡萄酒抗氧化剂 具有还原性,可用作葡萄酒抗氧化剂 |
| C.银氨溶液具有弱还原性,可用于制作银镜 |
| D.明矾溶于水能形成胶体,可用于自来水的杀菌消毒 |
您最近一年使用:0次
2023-08-18更新
|
180次组卷
|
3卷引用:选择题1-5
6 . 某小组同学探究溶液中的 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:
①在干燥试管中加入绿豆大小的金属钠,逐滴滴加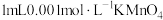 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。
②向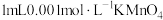 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。
③向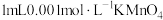 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。
下列说法不正确 的是
 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:①在干燥试管中加入绿豆大小的金属钠,逐滴滴加
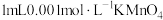 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。②向
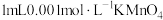 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。③向
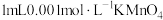 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。下列说法
| A.实验①中还可能观察到钠块浮在溶液表面,剧烈燃烧,发出黄色火焰 |
| B.实验②中的现象说明实验①中溶液变色的原因与产生的气体无关 |
C.实验③中的现象说明实验①中可能发生的反应: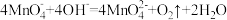 |
D.上述实验能证明溶液中的 可以被金属钠还原 可以被金属钠还原 |
您最近一年使用:0次
2023-05-07更新
|
1645次组卷
|
7卷引用:选择题11-14
(已下线)选择题11-14北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题(已下线)T12-化学反应及限度(已下线)第4讲 钠及其重要化合物北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题(已下线)选择题6-10湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
2023·北京西城·一模
名校
7 . 实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。

下列说法不正确 的是

下列说法
| A.有O2生成推测发生了反应:2Na2O2+2SO2=2Na2SO3+O2 |
| B.bc段O2含量下降与反应O2+2Na2SO3=2Na2SO4有关 |
| C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4 |
| D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的 |
您最近一年使用:0次
2023-03-31更新
|
1032次组卷
|
10卷引用:选择题11-14
2023·北京丰台·一模
8 . 某小组实验探究不同条件下 溶液与
溶液与 溶液的反应。
溶液的反应。
已知:
i. 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色)。
(棕黑色)。
ii. 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
(1)实验I~III的操作过程中,加⼊ 溶液和物质a时,应先加
溶液和物质a时,应先加___________ 。
(2)实验I中, 的还原产物为
的还原产物为___________ 。
(3)实验II中发生反应的离子方程式为___________ 。
(4)已知:可从电极反应⻆度分析物质氧化性和还原性的变化。用电极反应式表示实验III中溶液变绿时发⽣的氧化反应___________ 。
(5)解释实验III中“⼀段时间后绿色消失,产生棕黑色沉淀”的原因___________ 。
(6)若想观察 溶液与
溶液与 溶液反应后溶液为持续稳定的绿色,设计实验方案
溶液反应后溶液为持续稳定的绿色,设计实验方案___________ 。
(7)改用0.1
 溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式___________ 。
 溶液与
溶液与 溶液的反应。
溶液的反应。已知:
i.
 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色)。
(棕黑色)。ii.
 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。| 实验 | 序号 | 物质a | 实验现象 |
| 4滴物质a 6滴(约0.3mL)0.1   溶液 溶液
  溶液 溶液 | I | 3  溶液 溶液 | 紫色溶液变浅至几乎无色 |
| II |  | 紫色褪去,产生棕黑色沉淀 | |
| III | 6 NaOH溶液 NaOH溶液 | 溶液变绿,⼀段时间后绿色消失,产生棕黑色沉淀 |
 溶液和物质a时,应先加
溶液和物质a时,应先加(2)实验I中,
 的还原产物为
的还原产物为(3)实验II中发生反应的离子方程式为
(4)已知:可从电极反应⻆度分析物质氧化性和还原性的变化。用电极反应式表示实验III中溶液变绿时发⽣的氧化反应
(5)解释实验III中“⼀段时间后绿色消失,产生棕黑色沉淀”的原因
(6)若想观察
 溶液与
溶液与 溶液反应后溶液为持续稳定的绿色,设计实验方案
溶液反应后溶液为持续稳定的绿色,设计实验方案(7)改用0.1

 溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
您最近一年使用:0次
2023-03-24更新
|
489次组卷
|
3卷引用:专题21 实验探究题
2023·北京西城·模拟预测
名校
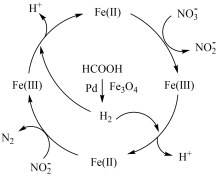
9 . 甲酸在纳米级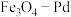 表面分解为活性
表面分解为活性 和
和 ,再经下列历程实现
,再经下列历程实现 的催化还原,进而减少硝酸盐污染。已知
的催化还原,进而减少硝酸盐污染。已知 (II)、
(II)、 (III)表示
(III)表示 中的二价铁和三价铁。下列说法
中的二价铁和三价铁。下列说法不正确 的是
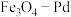 表面分解为活性
表面分解为活性 和
和 ,再经下列历程实现
,再经下列历程实现 的催化还原,进而减少硝酸盐污染。已知
的催化还原,进而减少硝酸盐污染。已知 (II)、
(II)、 (III)表示
(III)表示 中的二价铁和三价铁。下列说法
中的二价铁和三价铁。下列说法
| A.将催化剂处理成纳米级颗粒可增大甲酸分解的速率 |
| B.甲酸分解时,碳氢键和氧氢键发生了断裂 |
C.在整个历程中, 可还原 可还原 |
D.反应历程中生成的 可调节体系 可调节体系 ,有增强 ,有增强 氧化性的作用 氧化性的作用 |
您最近一年使用:0次
2023·北京石景山·模拟预测
名校
解题方法
10 . 一种利用低品位铜矿( 、CuS、FeO和
、CuS、FeO和 等)为原料制取CuCl的工艺流程如下:
等)为原料制取CuCl的工艺流程如下:
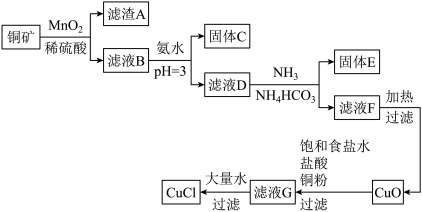
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时, 的溶度积常数
的溶度积常数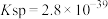 。
。
(1)铜矿中被 氧化的物质有
氧化的物质有_______ 。
(2)滤液D中铁离子的浓度约为_______ ,向滤液D中先通氨气的目的_______ 。
(3)固体E主要是 ,生成
,生成 的离子方程式是
的离子方程式是_______ 。
(4)滤液F加热生成 、
、 和CuO,反应的化学方程式是
和CuO,反应的化学方程式是_______ 。
(5)查阅资料:+1价Cu和 可以形成2种配离子
可以形成2种配离子 和
和 。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成
。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成_______ 。
(6)CuCl质量分数的测定
称取mg样品,溶于25mL过量的硫酸铁铵溶液( 将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与
将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与 发生特征反应,溶液呈红棕色),用含
发生特征反应,溶液呈红棕色),用含 的硫酸铁铈标准液滴定
的硫酸铁铈标准液滴定 ,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式_______ 。
 、CuS、FeO和
、CuS、FeO和 等)为原料制取CuCl的工艺流程如下:
等)为原料制取CuCl的工艺流程如下:
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,
 的溶度积常数
的溶度积常数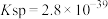 。
。(1)铜矿中被
 氧化的物质有
氧化的物质有(2)滤液D中铁离子的浓度约为
(3)固体E主要是
 ,生成
,生成 的离子方程式是
的离子方程式是(4)滤液F加热生成
 、
、 和CuO,反应的化学方程式是
和CuO,反应的化学方程式是(5)查阅资料:+1价Cu和
 可以形成2种配离子
可以形成2种配离子 和
和 。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成
。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成(6)CuCl质量分数的测定
称取mg样品,溶于25mL过量的硫酸铁铵溶液(
 将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与
将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与 发生特征反应,溶液呈红棕色),用含
发生特征反应,溶液呈红棕色),用含 的硫酸铁铈标准液滴定
的硫酸铁铈标准液滴定 ,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
您最近一年使用:0次
2023-03-17更新
|
541次组卷
|
6卷引用:专题20 工艺流程题
(已下线)专题20 工艺流程题北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(工业流程题)北京市石景山区2023-2024学年高三上学期一模考试化学试题北京市第一六一中学2023-2024学年高三下学期开学考化学试题北京市中国人民大学附属中学丰台学校2023-2024学年高三上学期12月月考化学试题