名校
1 . 某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。

(1)装置A中发生的化学反应的化学方程式为_____ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是____ (填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____ 性。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____ 。
(5)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_____ (填①或②),不合理的原因是_____ 。
(6)在上述装置中能表明SO2的还原性强于I2的现象是____ 。

(1)装置A中发生的化学反应的化学方程式为
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(5)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
(6)在上述装置中能表明SO2的还原性强于I2的现象是
您最近一年使用:0次
名校
解题方法
2 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是_______ (用化学方程式表示)。
(2)从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:_______ 。
(3)从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式_______ 。另外,其还原性可使酸性高锰酸钾溶液褪色,写出对应的离子方程式_______ 。
(4)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量氯水,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是_______ 。
②空气样品中SO2的体积分数为_______ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
(2)从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
(3)从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式
(4)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量氯水,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
名校
解题方法
3 . SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是( )
| A.有氧化性,无还原性,无酸性 |
| B.有氧化性,有还原性,有酸性 |
| C.有还原性,无氧化性,无酸性 |
| D.有还原性,无氧化性,有酸性 |
您最近一年使用:0次
2020-03-12更新
|
191次组卷
|
3卷引用:广西壮族自治区崇左市扶绥县第二中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
4 . 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是___ ;发生装置B应选择以下三种装置中的___ (填序号)。
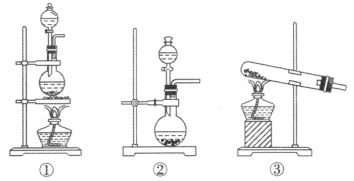
(2)D装置中主要反应的离子方程式为___ 。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体(SO2)”。写出对应的化学方程式:___ 。
(4)上述现象体现了浓硫酸的___ (填序号)
①酸性②吸水性③脱水性④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有1.12L(标准状况下)SO2气体生成,反应中转移电子__ mol,该反应中浓硫酸体现了___ 、___ 。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是

(2)D装置中主要反应的离子方程式为
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体(SO2)”。写出对应的化学方程式:
(4)上述现象体现了浓硫酸的
①酸性②吸水性③脱水性④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有1.12L(标准状况下)SO2气体生成,反应中转移电子
您最近一年使用:0次
2021-06-23更新
|
270次组卷
|
4卷引用:广西南宁市英华学校2020-2021学年高一上学期期末考试化学试题
解题方法
5 . 某研究性学习小组利用如图所示装置探究二氧化硫的性质。已知该实验过程可产生足量的二氧化硫。(装置中固定仪器未画出)

(1)A中所装试剂为铜片和__ (填试剂名称),导管F的作用是__ 。
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为__ ,证明SO2具有__ 性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液为__ (填字母)。
A.酸性高锰酸钾溶液 B.品红溶液
C.石蕊溶液 D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因,并设计实验验证。
可能原因:__ 。
实验验证:__ 。
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为__ 。
(6)指出上述装置中的不足之处:__ 。

(1)A中所装试剂为铜片和
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为
(3)装置B用于验证SO2的漂白性,则其中所装溶液为
A.酸性高锰酸钾溶液 B.品红溶液
C.石蕊溶液 D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因,并设计实验验证。
可能原因:
实验验证:
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为
(6)指出上述装置中的不足之处:
您最近一年使用:0次
6 . 课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌。
(1)同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是炭,原因是浓硫酸具有强_______ 。
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动。
【猜想与假设】浓硫酸与炭反应,生成大量气体使黑色固体膨胀。
【查阅资料】
Ⅰ.浓硫酸与炭在加热条件下反应,生成物中有 、
、 两种气体。
两种气体。
Ⅱ. 是一种具有刺激性气味的气体,也能与
是一种具有刺激性气味的气体,也能与 溶液反应生成白色沉淀。
溶液反应生成白色沉淀。
Ⅲ. 能使品红溶液褪色,而
能使品红溶液褪色,而 不能。
不能。
【实验探究】为验证炭与浓硫酸在加热条件下反应生成的气体产物,同学们在老师指导下设计并进行了如图实验。

【事实与结论】
(2)请将能得出对应结论的实验现象填入表中。
(3)炭与浓硫酸反应的化学方程式是_______ 。
浓硫酸与炭在加热条件下反应产生大量的 和
和 ,使黑色固体膨胀,形成“黑面包”,猜想成立。
,使黑色固体膨胀,形成“黑面包”,猜想成立。
【反思与交流】
(4)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是_______ 。
(5)若B、E中试剂交换,_______ (填“能”或“不能”)得出有 产生的结论,理由是
产生的结论,理由是_______ 。
(6)C中酸性高锰酸钾溶液的作用是_______ ,请用相应的离子方程式表示:_______ 。
(1)同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是炭,原因是浓硫酸具有强
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动。
【猜想与假设】浓硫酸与炭反应,生成大量气体使黑色固体膨胀。
【查阅资料】
Ⅰ.浓硫酸与炭在加热条件下反应,生成物中有
 、
、 两种气体。
两种气体。Ⅱ.
 是一种具有刺激性气味的气体,也能与
是一种具有刺激性气味的气体,也能与 溶液反应生成白色沉淀。
溶液反应生成白色沉淀。Ⅲ.
 能使品红溶液褪色,而
能使品红溶液褪色,而 不能。
不能。【实验探究】为验证炭与浓硫酸在加热条件下反应生成的气体产物,同学们在老师指导下设计并进行了如图实验。

【事实与结论】
(2)请将能得出对应结论的实验现象填入表中。
| 验证气体 | 实验现象 | 实验结论 |
 | 有 产生 产生 | |
 | 有 产生 产生 |
浓硫酸与炭在加热条件下反应产生大量的
 和
和 ,使黑色固体膨胀,形成“黑面包”,猜想成立。
,使黑色固体膨胀,形成“黑面包”,猜想成立。【反思与交流】
(4)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是
(5)若B、E中试剂交换,
 产生的结论,理由是
产生的结论,理由是(6)C中酸性高锰酸钾溶液的作用是
您最近一年使用:0次
13-14高一·河北保定·课时练习
解题方法
7 . 某学习小组进行浓硫酸对蔗糖的脱水实验,“在200 mL烧杯中放入20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%的浓硫酸,迅速搅拌”进行如下探究。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。按压此黑色物质时,感觉较硬,放在水中呈漂浮状态。
同学们由上述现象推测出下列结论:①浓硫酸具有强氧化性;②浓硫酸具有吸水性;③浓硫酸具有脱水性;④浓硫酸具有酸性;⑤黑色物质具有强吸附性,其中依据不充分的是_______ (填序号)。
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如图装置:

试回答下列问题:
①图1的A中最好选用图2中的装置_______ (填编号)。

②图1的B装置所装试剂是_______ ;D装置中试剂的作用是_______ ;E装置中发生的现象是_______ 。
③图1的A装置中使蔗糖先变黑的化学反应方程式为_______ ;后体积膨胀的化学方程式为_______ 。
④某学生进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_______ 。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。按压此黑色物质时,感觉较硬,放在水中呈漂浮状态。
同学们由上述现象推测出下列结论:①浓硫酸具有强氧化性;②浓硫酸具有吸水性;③浓硫酸具有脱水性;④浓硫酸具有酸性;⑤黑色物质具有强吸附性,其中依据不充分的是
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如图装置:

试回答下列问题:
①图1的A中最好选用图2中的装置

②图1的B装置所装试剂是
③图1的A装置中使蔗糖先变黑的化学反应方程式为
④某学生进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因
您最近一年使用:0次
8 . 回答下列问题:
(1)课堂上,老师取20g蔗糖放入不烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强___________ 。
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动。
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀。
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体。
Ⅱ.SO2是一种具有刺激性气味的气体,也能与Ca(OH)2溶液反应生成白色沉淀。
Ⅲ.SO2能使品红溶液褪色,而CO2不能。
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:

【事实与结论】
(2)请将能得出对应结论的实验现象填入表中。
(3)碳与浓硫酸反应的化学方程式是___________ 。;浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立。
【反思与交流】
(4)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是___________ 。
(5)若B、E中试剂交换,___________ (填“能”或“不能”)得出有CO2产生的结论,理由是___________ 。
(6)C中酸性高锰酸钾溶液的作用是___________ 。
(1)课堂上,老师取20g蔗糖放入不烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动。
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀。
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体。
Ⅱ.SO2是一种具有刺激性气味的气体,也能与Ca(OH)2溶液反应生成白色沉淀。
Ⅲ.SO2能使品红溶液褪色,而CO2不能。
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:

【事实与结论】
(2)请将能得出对应结论的实验现象填入表中。
| 验证气体 | 实验现象 | 实验结论 |
| SO2 | 有SO2产生 | |
| CO2 | 有CO2产生 |
【反思与交流】
(4)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是
(5)若B、E中试剂交换,
(6)C中酸性高锰酸钾溶液的作用是
您最近一年使用:0次
解题方法
9 . 由下列仪器组成的一套装置制取 并验证它有氧化性、还原性和漂白性(图中铁架台、铁夹等省略,装置③中
并验证它有氧化性、还原性和漂白性(图中铁架台、铁夹等省略,装置③中 管气体向上流出)。②、④、⑤中所用试剂只能从以下物质中选用:氯水、浓硫酸、溴水、硝酸、品红溶液、氢氧化钠溶液、石灰水。
管气体向上流出)。②、④、⑤中所用试剂只能从以下物质中选用:氯水、浓硫酸、溴水、硝酸、品红溶液、氢氧化钠溶液、石灰水。

(1)连接仪器时,导气管连接顺序从左到右 接
接_______  填字母,下同
填字母,下同 、
、_______ 接_______ 、 接
接 、
、_______ 接 、
、_______ 接_______ 。
(2)装置②用以检验 的还原性,所盛试剂最好是
的还原性,所盛试剂最好是_______ ,装置④中所盛试剂最好是_______ ,装置⑤中所盛试剂最好是_______ ,目的是_______ 。
(3)仪器连接好后,怎样检查装置①的气密性,简述操作要点:_______ 。
(4)写出装置①中反应的化学方程式:_______ ,写出装置③中反应的化学方程式:_______ 。
 并验证它有氧化性、还原性和漂白性(图中铁架台、铁夹等省略,装置③中
并验证它有氧化性、还原性和漂白性(图中铁架台、铁夹等省略,装置③中 管气体向上流出)。②、④、⑤中所用试剂只能从以下物质中选用:氯水、浓硫酸、溴水、硝酸、品红溶液、氢氧化钠溶液、石灰水。
管气体向上流出)。②、④、⑤中所用试剂只能从以下物质中选用:氯水、浓硫酸、溴水、硝酸、品红溶液、氢氧化钠溶液、石灰水。
(1)连接仪器时,导气管连接顺序从左到右
 接
接 填字母,下同
填字母,下同 、
、 接
接 、
、 、
、(2)装置②用以检验
 的还原性,所盛试剂最好是
的还原性,所盛试剂最好是(3)仪器连接好后,怎样检查装置①的气密性,简述操作要点:
(4)写出装置①中反应的化学方程式:
您最近一年使用:0次
名校
10 . 我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。某小组同学利用反应:S+2H2SO4(浓) 3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
 3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是
3SO2↑+2H2O,进行如图所示的含硫物质的转化实验(夹持装置略)。下列说法正确的是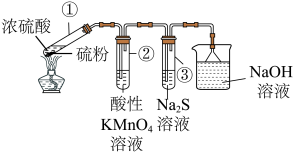
| A.试管①中,浓硫酸体现了强氧化性和脱水性 |
| B.试管②中,溶液褪色,体现+4价硫元素的氧化性 |
| C.试管③中,有淡黄色沉淀出现,体现-2价硫元素的还原性 |
| D.烧杯中的反应为SO3+2NaOH=Na2SO4+H2O |
您最近一年使用:0次
2023-03-08更新
|
2432次组卷
|
16卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题
广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题广东省2023年第一次高中学业水平测试化学试题四川省乐山沫若中学2022-2023学年高一下学期3月月考化学试题广东省阳山县南阳中学2022-2023学年高一下学期第一次月考化学试题湖南省常德市汉寿县第一中学2022-2023学年高二下学期第一次月考化学试题云南省玉溪第一中学2022-2023学年高一下学期第一次月考化学试题 云南省昆明市官渡区第三中学2022-2023学年高一下学期期中考试化学试题云南省下关第一中学2022-2023学年高二下学期5月期中考试化学试题广东省梅州市2022-2023学年高一下学期7月期末考试化学试题(已下线)2023年广东卷高考真题变式题(选择题6-10)河南省焦作市博爱县第一中学2022-2023学年高一下学期6月期末考试化学试题(已下线)专题十二 硫及其化合物(已下线)合格考真题汇编11硫元素及其化合物第3课时 不同价态含硫物质的转化广东省信宜市第二中学2022-2023学年高一下学期化学期中热身试试卷四川省泸州市龙马潭区2023-2024学年高一下学期5月期中考试化学试题



