名校
1 . 下列反应的离子方程式正确的是
A.少量 通入 通入 中: 中: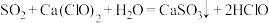 |
B.向二元弱酸 溶液中滴入足量烧碱溶液: 溶液中滴入足量烧碱溶液: |
C. 溶于HI溶液: 溶于HI溶液: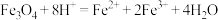 |
D.向含 的溶液通入标准状况下 的溶液通入标准状况下 : :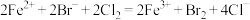 |
您最近一年使用:0次
名校
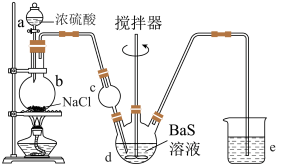
2 . 某实验小组以BaS溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤1:制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。
步骤2:测定产品中 的含量
的含量
①称取产品1.0000g,用100mL水溶解、酸化、加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的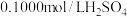 溶液,
溶液,
③沉淀完全后,经陈化、过滤、洗涤、烘干至恒重等步骤,称得白色固体质量为0.9320g。
(1)装置a的名称是___________ ,装置b中发生反应的化学方程式为___________ 。
(2)装置c的作用是___________ ,装置e中可选用的试剂是___________ (填字母)。
A.NaOH溶液 B.饱和食盐水 C.石灰乳 D.浓硫酸
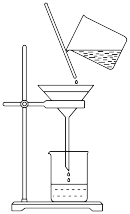
(3)如图过滤操作中不规范的有___________ 处;过滤后,洗涤沉淀的方法是___________ 。___________ 次。
(5)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤1:制备

按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。步骤2:测定产品中
 的含量
的含量①称取产品1.0000g,用100mL水溶解、酸化、加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的
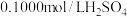 溶液,
溶液,③沉淀完全后,经陈化、过滤、洗涤、烘干至恒重等步骤,称得白色固体质量为0.9320g。
(1)装置a的名称是
(2)装置c的作用是
A.NaOH溶液 B.饱和食盐水 C.石灰乳 D.浓硫酸
(3)如图过滤操作中不规范的有
(5)产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-18更新
|
820次组卷
|
7卷引用:2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷
2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷四川省资阳市2024届高三上学期第一次诊断性考试理综化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题(已下线)实验探究题(已下线)T27-实验综合题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)T15-实验综合题
解题方法
3 . 某实验小组同学用铜与浓硫酸反应制取SO2,验证SO2性质并制备NaHSO3,设计如图所示实验装置。
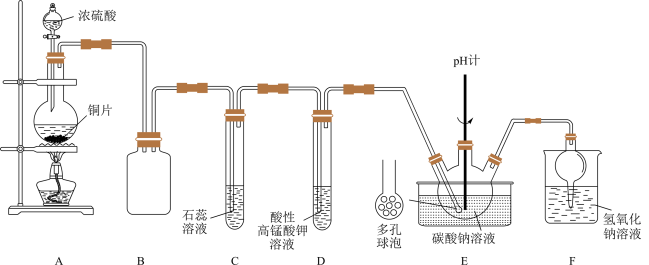
回答下列问题:
(1)C中的实验现象是_____ ,F的作用是_____ 。
(2)A中发生反应的化学方程式是_____ 。
(3)试管D中发生反应的离子方程式为_____ 。
(4)装置E中设计多孔球泡的目的是_____ 。
(5)向装置E中通入SO2可制得NaHSO3.已知:Na2SO3水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通入SO2的实验操作为_____ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为_____ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_____ ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

回答下列问题:
(1)C中的实验现象是
(2)A中发生反应的化学方程式是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)向装置E中通入SO2可制得NaHSO3.已知:Na2SO3水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
随pH的分布如图1所示,Na2SO4的溶解度曲线如图2所示。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通入SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。

回答下列问题:
(1)a中试剂为__________ ,b中试剂为__________ ,c中试剂为____________________ 。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________ 。
(3)d中的试剂为__________________ 。
(4)实验中要控制SO2生成速率,可以采取的措施有________________ (写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________ 。

回答下列问题:
(1)a中试剂为
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是
(3)d中的试剂为
(4)实验中要控制SO2生成速率,可以采取的措施有
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
您最近一年使用:0次
2020-02-23更新
|
253次组卷
|
2卷引用:广西壮族自治区崇左市大新县大新中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
5 . Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。
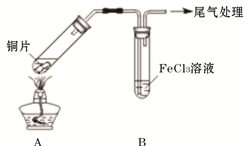
①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________ 。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________ 。
(3)已知:B中溶液变红的反应:Fe3++6SO2 Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________ 。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________ 。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是
(2)用如下图所示装置进行实验。

①将A装置加热,反应的化学方程式是
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是
(3)已知:B中溶液变红的反应:Fe3++6SO2
 Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因
您最近一年使用:0次
13-14高一上·广西柳州·期末
名校
解题方法
6 . 请回答下列问题
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着___________ 作用,总反应式为___________ 。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,___________ 。总反应式为___________ 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:___________ 。
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是___________ 。
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目___________ 。
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次



