名校
解题方法
1 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
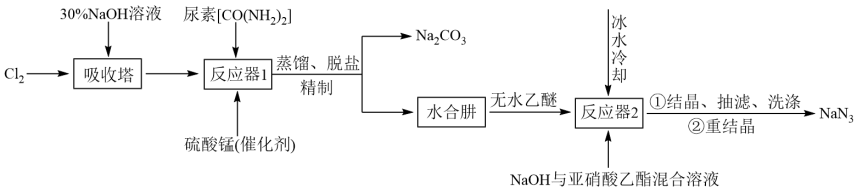
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为_______ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(3)反应器2中加入无水乙醚的作用是_______ 。
(4)已知亚硝酸乙酯的结构简式为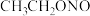 ,写出反应器2中生成
,写出反应器2中生成 和
和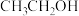 的化学方程式:
的化学方程式:_______ 。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为_______ 。
(5)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(6)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
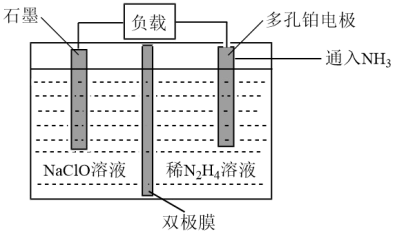
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为
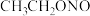 ,写出反应器2中生成
,写出反应器2中生成 和
和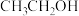 的化学方程式:
的化学方程式: ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为(5)反应器1要控制NaClO溶液的用量,其主要目的是
(6)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
您最近一年使用:0次
2022-04-16更新
|
576次组卷
|
5卷引用:河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题
河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题湖北省九师联盟2022届高三 三模考试化学试题
解题方法
2 . 硫代硫酸钠晶体(Na2S2O3·5H2O)具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,研究过程如下:
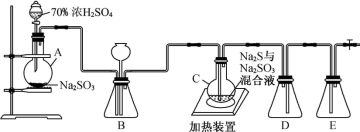
请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)装置A中发生的化学反应方程式为___________ 。
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有___________ 。
(3)C装置中放入无水乙醇的目的是___________ 。
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
(4)已知滴定过程中发生的反应: 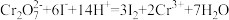 ;
;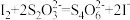 。则样品纯度为
。则样品纯度为___________ (写出化简后表达式)。
Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是___________ 。
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)=___________ ,若D中ClO-与 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为___________ 。

请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)装置A中发生的化学反应方程式为
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有
(3)C装置中放入无水乙醇的目的是
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗样品溶液体积/mL | 24.79 | 22.30 | 24.81 |
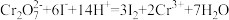 ;
;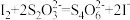 。则样品纯度为
。则样品纯度为Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、
 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)= 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
您最近一年使用:0次
解题方法
3 . 高铁酸钾(K2FeO4)是一种高效、多功能的新型非氯绿色消毒剂,主要用于饮水处理,化工生产中作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂。某实验小组利用如图装置和药品制备高铁酸钾并探究其性质。
已知:K2FeO4为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在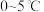 的强碱性溶液中较稳定。
的强碱性溶液中较稳定。
(1)制备 K2FeO4 (部分夹持装置略)
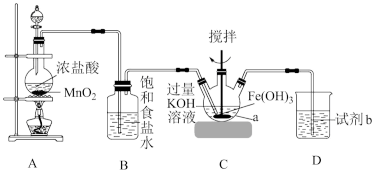
①仪器a的名称是___________ 。
②装置A为实验室制取氯气的装置,装置A中发生反应的离子方程式为___________ 。
③在搅拌下,将 通入含
通入含 的悬浊液(含
的悬浊液(含 )中即可制取K2FeO4,写出该反应的化学方程式:
)中即可制取K2FeO4,写出该反应的化学方程式:___________ 。
④在下列试剂中,试剂b的最佳选择是___________ (填标号)。
A.氢氧化钠溶液 B.澄清石灰水 C.浓硫酸 D.浓氨水
(2)制备的高铁酸钾粗产品中含有氢氧化钾、氯化钾、氢氧化铁等杂质,请完成提纯高铁酸钾的实验设计(实验药品:蒸馏水、乙醇、饱和 溶液、饱和
溶液、饱和 溶液、冷的
溶液、冷的 稀溶液)。
稀溶液)。
提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于___________ 中;
②过滤除去___________ (填化学式),取滤液将其置于冰水浴中,向滤液中加入饱和 溶液;
溶液;
③搅拌、静置、过滤,用___________ 洗涤2~3次;④在真空干燥箱中干燥。
(3) K2FeO4性质探究
①取少量提纯后的晶体于烧杯中,加入足量 溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是
溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是___________ (填化学式)。
②根据 的制备实验得出氧化性:
的制备实验得出氧化性:
___________ (填“>”或“<”) ,而步骤①中实验表明,
,而步骤①中实验表明, 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
③ 时,
时,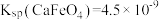 ,若要使
,若要使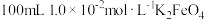 溶液中的
溶液中的 完全沉淀[
完全沉淀[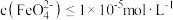 视为沉淀完全],理论上要加入
视为沉淀完全],理论上要加入 的
的
___________  (忽略溶液体积变化)。
(忽略溶液体积变化)。
已知:K2FeO4为紫色固体,具有强氧化性,易溶于水、微溶于浓碱溶液、不溶于乙醇,在
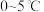 的强碱性溶液中较稳定。
的强碱性溶液中较稳定。(1)制备 K2FeO4 (部分夹持装置略)

①仪器a的名称是
②装置A为实验室制取氯气的装置,装置A中发生反应的离子方程式为
③在搅拌下,将
 通入含
通入含 的悬浊液(含
的悬浊液(含 )中即可制取K2FeO4,写出该反应的化学方程式:
)中即可制取K2FeO4,写出该反应的化学方程式:④在下列试剂中,试剂b的最佳选择是
A.氢氧化钠溶液 B.澄清石灰水 C.浓硫酸 D.浓氨水
(2)制备的高铁酸钾粗产品中含有氢氧化钾、氯化钾、氢氧化铁等杂质,请完成提纯高铁酸钾的实验设计(实验药品:蒸馏水、乙醇、饱和
 溶液、饱和
溶液、饱和 溶液、冷的
溶液、冷的 稀溶液)。
稀溶液)。提纯高铁酸钾的实验步骤:①取一定量的高铁酸钾粗产品,溶于
②过滤除去
 溶液;
溶液;③搅拌、静置、过滤,用
(3) K2FeO4性质探究
①取少量提纯后的晶体于烧杯中,加入足量
 溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是
溶液,使固体完全溶解。往溶解后的溶液中加入稀盐酸,有黄绿色气体单质生成,该反应中被氧化的是②根据
 的制备实验得出氧化性:
的制备实验得出氧化性:
 ,而步骤①中实验表明,
,而步骤①中实验表明, 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是③
 时,
时,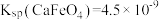 ,若要使
,若要使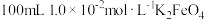 溶液中的
溶液中的 完全沉淀[
完全沉淀[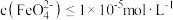 视为沉淀完全],理论上要加入
视为沉淀完全],理论上要加入 的
的
 (忽略溶液体积变化)。
(忽略溶液体积变化)。
您最近一年使用:0次
名校
解题方法
4 . 某化学小组在实验室制备KMnO4,并利用其性质测定血液中钙的含量。请回答:
(一)KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步骤Ⅰ.将软锰矿(主要成分MnO2)和KOH固体混合后装入图所示装置A中,在空气中加热,并不断用B搅拌最终得到K2MnO4。
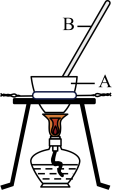
(1)仪器A、B分别是_______ (填序号)。
A.瓷坩埚、玻璃棒B.石英坩埚、玻璃棒C.铁坩埚、玻璃棒D.铁坩埚、铁棒
(2)装置A处反应生成K2MnO4的化学方程式为_______ 。
步骤Ⅱ.KMnO4的制备。
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3 +2H2O═2
+2H2O═2 +MnO2↓+4OH﹣。
+MnO2↓+4OH﹣。
(3)甲同学利用Cl2在碱性条件下氧化K2MnO4制备KMnO4其装置如图所示(夹持和加热装置略)。
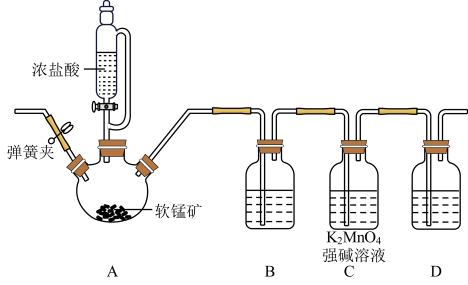
回答下列问题:
①装置B中的试剂为_______ ;若没有B装置则产率会_______ (填“增大”“减小”或“不变”)。
②当C中反应结束后,后续操作是熄灭酒精灯,_______ ,拆除装置。
③请写出D中的生成物在生活中的一个应用:_______ 。
(4)乙同学利用已知信息和部分物质溶解度数据表,提出另一种新的制备方法:向上述K2MnO4溶液中加入_______ (请从下列物质中选出一种最合适的物质),充分反应,然后过滤,再将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥,得KMnO4晶体。
A.亚硫酸氢钾B.硫酸氢钠C.稀盐酸D.稀醋酸
(二)人体血液里Ca2+含量的测定。
抽取血样20.00mL,加适量的草酸铵[(NH4)2C2O4]溶液;可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用0.0020mol/L酸性KMnO4溶液滴定,共消耗9.00mL酸性KMnO4溶液。
(1)滴定时,当出现_______ 现象,即可确定反应达到终点。
(2)经过计算,血液样品中Ca2+的浓度为_______ mg/cm3。
(一)KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步骤Ⅰ.将软锰矿(主要成分MnO2)和KOH固体混合后装入图所示装置A中,在空气中加热,并不断用B搅拌最终得到K2MnO4。

(1)仪器A、B分别是
A.瓷坩埚、玻璃棒B.石英坩埚、玻璃棒C.铁坩埚、玻璃棒D.铁坩埚、铁棒
(2)装置A处反应生成K2MnO4的化学方程式为
步骤Ⅱ.KMnO4的制备。
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3
 +2H2O═2
+2H2O═2 +MnO2↓+4OH﹣。
+MnO2↓+4OH﹣。(3)甲同学利用Cl2在碱性条件下氧化K2MnO4制备KMnO4其装置如图所示(夹持和加热装置略)。

回答下列问题:
①装置B中的试剂为
②当C中反应结束后,后续操作是熄灭酒精灯,
③请写出D中的生成物在生活中的一个应用:
(4)乙同学利用已知信息和部分物质溶解度数据表,提出另一种新的制备方法:向上述K2MnO4溶液中加入
| 物质 | KMnO4 | K2SO4 | CH3COOK | Na2SO4 |
| 20℃溶解度 | 6.4 | 11.1 | 217 | 30 |
(二)人体血液里Ca2+含量的测定。
抽取血样20.00mL,加适量的草酸铵[(NH4)2C2O4]溶液;可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用0.0020mol/L酸性KMnO4溶液滴定,共消耗9.00mL酸性KMnO4溶液。
(1)滴定时,当出现
(2)经过计算,血液样品中Ca2+的浓度为
您最近一年使用:0次
2020-11-15更新
|
542次组卷
|
3卷引用:陕西省汉中市龙岗学校2021届高三上学期第二次月考化学试题
陕西省汉中市龙岗学校2021届高三上学期第二次月考化学试题江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)培优02 无机制备类实验 提高训练-2021年高考化学大题培优练(新高考地区专用)



