1 . 氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。“84”消毒液说明书如图,请回答下列问题:
(1)漂白粉的主要成分为___________ (填化学式,下同),有效成分为___________ 。工业上用石灰乳和氯气制备漂白粉,写出反应的化学方程式:___________ 。
(2)洁厕剂的主要成分为稀盐酸,用化学方程式解释注意事项中不可与洁厕剂混合使用的原因:___________ 。
(3) 可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为
可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为________ (填标号)。
A.增强漂白能力和消毒作用
B.将 转化为较稳定的物质,便于保存和运输
转化为较稳定的物质,便于保存和运输
C.提高氯的质量分数,有利于漂白、消毒
(4)某小组在实验室制备“84”消毒液,并进行性质探究。
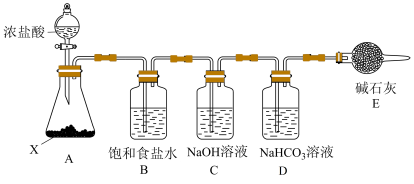
①装置E盛放碱石灰的仪器的名称是___________ ,装置E的作用是___________ 。
②若撤去装置B,则可能产生的后果是___________ 。
③装置C中发生制备消毒液的反应,写出反应的离子方程式:___________ 。
| “84”消毒液说明书 | 药品名称 | “84”消毒液 |
| 主要成分 | NaClO,有效氯含量为 | |
| 注意事项 | 不可与洁厕剂或其他消毒液混合使用 | |
| 用法用量 | 稀释后洗刷白色衣物、浴缸等(1:200水溶液),餐饮具、瓜果等(1:100水溶液) |
(1)漂白粉的主要成分为
(2)洁厕剂的主要成分为稀盐酸,用化学方程式解释注意事项中不可与洁厕剂混合使用的原因:
(3)
 可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为
可直接用于杀菌消毒,但常常把氯气制成漂白粉或“84”消毒液,主要目的为A.增强漂白能力和消毒作用
B.将
 转化为较稳定的物质,便于保存和运输
转化为较稳定的物质,便于保存和运输C.提高氯的质量分数,有利于漂白、消毒
(4)某小组在实验室制备“84”消毒液,并进行性质探究。

①装置E盛放碱石灰的仪器的名称是
②若撤去装置B,则可能产生的后果是
③装置C中发生制备消毒液的反应,写出反应的离子方程式:
您最近半年使用:0次
2023-12-07更新
|
119次组卷
|
2卷引用:江西省赣州市十八县市2023-2024学年高一上学期期中考试化学试题
名校
解题方法
2 . 某化学小组同学利用二氧化锰和浓盐酸制备氯气,再用氯气制备高锰酸钾、次氯酸钠和氯水。
已知:锰酸钾为墨绿色晶体,其水溶液呈深绿色,可以与酸和氯气反应,发生反应的离子方程式分别为: 、
、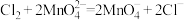 。
。
Ⅰ.制备氯气
该小组同学设计了如下气体发生装置。

(1)装置A中生成氯气的离子方程式为___________ 。
(2)装置A在放入药品前需检查气密性,其方法是___________ 。
(3)装置B的特点是___________ (填字母序号)。
a.可以随时添加浓盐酸
b.可以控制反应的开始和结束
c.与装置A相比,产生的气流更稳定
Ⅱ.制备高锰酸钾、次氯酸钠和氯水
该小组同学利用装置B~F完成实验。

(4)若装置C、D互换位置,装置D中可观察到的现象是___________ 。
(5)次氯酸钠高于35℃容易分解,制备次氯酸钠强碱性溶液时需注意的两个关键问题是___________ 。
(6)装置F中小漏斗的作用是___________ 。
Ⅲ.产品中含量测定
①称取Ⅱ中最终所得固体样品0.3500 g,用蒸馏水溶解,定容于100 mL容量瓶中,所得溶液记为溶液X。
②准确称取0.1340 g草酸钠,加蒸馏水50 mL使其溶解,再加入10 mL 3.0 mol/L 溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为:
溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为: )
)
(7)所得产品中 的质量分数为
的质量分数为___________ (结果保留三位有效数字)。
已知:锰酸钾为墨绿色晶体,其水溶液呈深绿色,可以与酸和氯气反应,发生反应的离子方程式分别为:
 、
、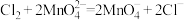 。
。Ⅰ.制备氯气
该小组同学设计了如下气体发生装置。

(1)装置A中生成氯气的离子方程式为
(2)装置A在放入药品前需检查气密性,其方法是
(3)装置B的特点是
a.可以随时添加浓盐酸
b.可以控制反应的开始和结束
c.与装置A相比,产生的气流更稳定
Ⅱ.制备高锰酸钾、次氯酸钠和氯水
该小组同学利用装置B~F完成实验。

(4)若装置C、D互换位置,装置D中可观察到的现象是
(5)次氯酸钠高于35℃容易分解,制备次氯酸钠强碱性溶液时需注意的两个关键问题是
(6)装置F中小漏斗的作用是
Ⅲ.产品中含量测定
①称取Ⅱ中最终所得固体样品0.3500 g,用蒸馏水溶解,定容于100 mL容量瓶中,所得溶液记为溶液X。
②准确称取0.1340 g草酸钠,加蒸馏水50 mL使其溶解,再加入10 mL 3.0 mol/L
 溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为:
溶液,75~85℃水浴加热,向其中逐滴滴加溶液X,恰好反应完全,记录消耗溶液X的体积,重复上述操作三次,平均消耗溶液X的体积为20.00 mL。(已知高锰酸钾发生反应的离子方程式为: )
)(7)所得产品中
 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
3 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是“84”消毒液,可以说化学让生活更美好。图为“84”消毒液说明书。请回答下列问题:
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式___________ ,其有效成分为___________ (写化学式)。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___________ (用离子方程式表达)。
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式___________ 。
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1:200水溶液;餐饮具、瓜果等1:100水溶液 |
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近半年使用:0次
名校
解题方法
4 . 二氯异氰尿酸钠(C3N3O3Cl2Na)是一种高效、安全的消毒剂。实验室可用如图所示装置制备二氯异氰尿酸钠(加热和夹持装置均已略去),实验原理为2NaClO+C3H3N3O3 C3N3O3Cl2Na+NaOH+H2O ΔH<0。
C3N3O3Cl2Na+NaOH+H2O ΔH<0。
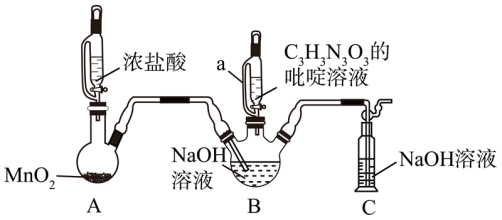
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ 。
(2)当观察到B中液面上方有黄绿色气体时,打开装置a的活塞加入C3H3N3O3的吡啶溶液,此时_______ (填“继续”或“停止”)通入氯气。
(3)实验过程中B容器置于冷水浴的原因除降低其溶解度,便于分离产品外还有_______ 。
(4)装置C中发生反应的化学方程式为_______ 。
(5)上述装置存在一处缺陷,导致B中NaOH溶液的利用率较低,改进的方法是_______ 。
(6)通过下列步骤测定样品中二氯异氰尿酸钠的含量。
I.准确称取ag样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸生成HClO ;
Ⅱ.再加入过量KI溶液,密封在暗处静置5min;
Ⅲ.用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗Na2 S2O3溶液V mL。
已知:HClO+2I—+H+=I2+Cl-+H2O; I2+2S2O =S4O
=S4O +2I—。
+2I—。
①步骤I中生成HClO的离子方程式为_______ 。
②步骤Ⅲ中所选的指示剂为_______ 。
③该样品中二氯异氰尿酸钠的质量分数为_______ %(用含a、V的代数式表示)。
 C3N3O3Cl2Na+NaOH+H2O ΔH<0。
C3N3O3Cl2Na+NaOH+H2O ΔH<0。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)当观察到B中液面上方有黄绿色气体时,打开装置a的活塞加入C3H3N3O3的吡啶溶液,此时
(3)实验过程中B容器置于冷水浴的原因除降低其溶解度,便于分离产品外还有
(4)装置C中发生反应的化学方程式为
(5)上述装置存在一处缺陷,导致B中NaOH溶液的利用率较低,改进的方法是
(6)通过下列步骤测定样品中二氯异氰尿酸钠的含量。
I.准确称取ag样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸生成HClO ;
Ⅱ.再加入过量KI溶液,密封在暗处静置5min;
Ⅲ.用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗Na2 S2O3溶液V mL。
已知:HClO+2I—+H+=I2+Cl-+H2O; I2+2S2O
 =S4O
=S4O +2I—。
+2I—。①步骤I中生成HClO的离子方程式为
②步骤Ⅲ中所选的指示剂为
③该样品中二氯异氰尿酸钠的质量分数为
您最近半年使用:0次
名校
5 . 新冠肺炎使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。图为84消毒液说明书,请回答下列问题。
(1)①洁厕剂主要成分为稀盐酸,用化学方程式解释注意事项中“不可与洁厕剂混合使用”的原因 _______ 。
②Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉或84消毒液,主要目的_______ 。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.提高氯的质量分数,有利于漂白、消毒
(2)某小组在实验室制备84消毒液,并进行性质探究。
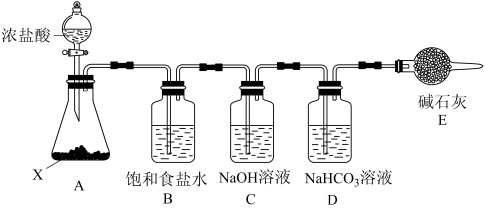
①装置 的名称是
的名称是_______ 。
②能否撤去装置B并说明理由_______ 。
③已知酸性:H2CO3>HClO>HCO ,已知氯气与NaHCO3溶液反应的氧化产物中Cl为+1价,请写出该反应的化学方程式
,已知氯气与NaHCO3溶液反应的氧化产物中Cl为+1价,请写出该反应的化学方程式_______ 。
(3)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25 g/L计算,该消毒液的NaClO的物质的量浓度是_______ mol·L-1。
| 84消毒液说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00 g/L~60.00 g/L | |
| 注意事项 | 不可与洁厕剂或其他消毒液混合使用 | |
| 用法用量 | 稀释后洗刷白色衣物、浴缸等1:200水溶液,餐饮具,瓜果等1:100水溶液 |
②Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉或84消毒液,主要目的
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.提高氯的质量分数,有利于漂白、消毒
(2)某小组在实验室制备84消毒液,并进行性质探究。

①装置
 的名称是
的名称是②能否撤去装置B并说明理由
③已知酸性:H2CO3>HClO>HCO
 ,已知氯气与NaHCO3溶液反应的氧化产物中Cl为+1价,请写出该反应的化学方程式
,已知氯气与NaHCO3溶液反应的氧化产物中Cl为+1价,请写出该反应的化学方程式(3)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25 g/L计算,该消毒液的NaClO的物质的量浓度是
您最近半年使用:0次
名校
解题方法
6 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②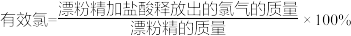 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
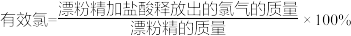 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近半年使用:0次
名校
解题方法
7 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:装置A中反应为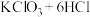 (浓)
(浓)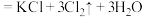 ;
;
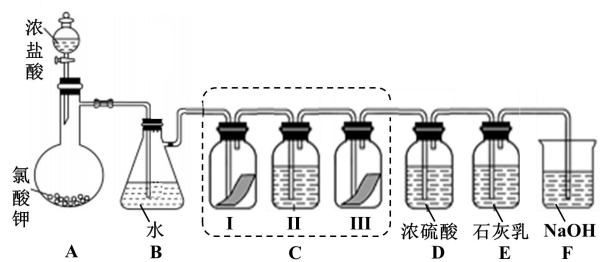
(1)写出B装置中反应的化学方程式_______ 。实验结束后,立即将B中溶液滴几滴在 试纸上,可观察到的现象是
试纸上,可观察到的现象是_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质正确的是_______。
①干燥的有色布条②湿润的有色布条③浓硫酸④碱石灰(固体氢氧化钠和氧化钙组成的混合物)
(3)氯水具有漂白性,将氯水制成漂白粉的主要目的是_______(填标号)。
(4)F装置的作用是_______ ,盛放的试剂是_______ 。
(5)为测定E中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 至产生沉淀最大值时,该过程的化学方程式为
至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
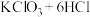 (浓)
(浓)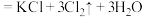 ;
;
(1)写出B装置中反应的化学方程式
 试纸上,可观察到的现象是
试纸上,可观察到的现象是(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质正确的是_______。
①干燥的有色布条②湿润的有色布条③浓硫酸④碱石灰(固体氢氧化钠和氧化钙组成的混合物)
| A.①④② | B.①③② | C.②③① | D.②④① |
| A.增强漂白能力和消毒能力 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白消毒 |
(5)为测定E中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入
 至产生沉淀最大值时,该过程的化学方程式为
至产生沉淀最大值时,该过程的化学方程式为
您最近半年使用:0次
名校
解题方法
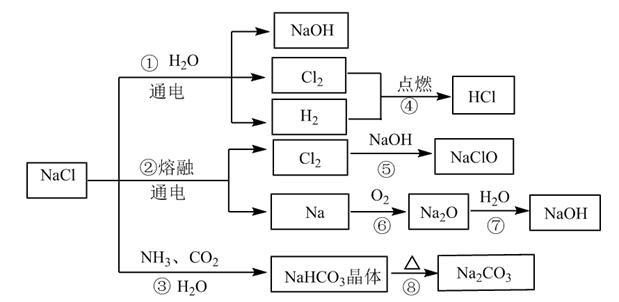
8 . NaCl是一种化工原料,可以制备多种物质,如图所示。
请回答下列问题:
(1)图所列物质中属于电解质的有___________ 种,转化反应中属于氧化还原反应的有___________ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是___________ 。
(3)反应④的现象是___________ ;反应⑤的化学方程式为___________ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=___________ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是___________ 。

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
您最近半年使用:0次
2021-11-13更新
|
356次组卷
|
2卷引用:辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题
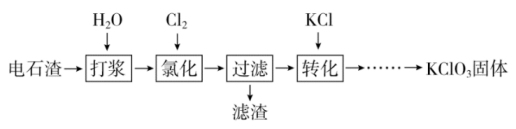
9 . 某小组以电石渣[主要成分为 和
和 ]为原料制备
]为原料制备 晶体,流程如下:
晶体,流程如下:
已知:氯化时 与
与 反应生成
反应生成 ,
, 进一步转化生成
进一步转化生成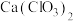 ,少量
,少量 分解生成
分解生成 和
和 。请回答:
。请回答:
(1)氯化时装置如图所示,B中的试剂是___________ ;若C中导管处堵塞则B中的现象是___________ 。
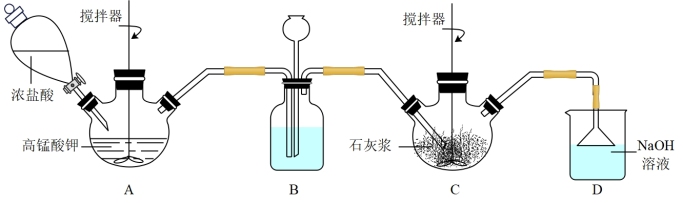
(2)下列说法不正确 的是___________ 。
A.打浆时加水形成石灰浆的目的是使 与
与 充分反应
充分反应
B.氯化时应快速通入氯气以提高氯气的转化率
C.过滤得到的滤渣中含有 、
、
D.过滤后的滤液中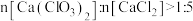
(3)对抽滤后获得的 晶体进行洗涤的方法是
晶体进行洗涤的方法是___________ 。
(4)某小组认为获得的 产品中含有KCl、
产品中含有KCl、 两种物质,为测定
两种物质,为测定 的含量,从下列选项中选出合理的操作(操作可以重复使用)并排序:称取mg样品→用蒸馏水溶解→___________→___________→___________→___________→___________→___________→计算,
的含量,从下列选项中选出合理的操作(操作可以重复使用)并排序:称取mg样品→用蒸馏水溶解→___________→___________→___________→___________→___________→___________→计算,___________
a.往滤液中加入足量的 、
、 溶液b.过滤、洗涤
溶液b.过滤、洗涤
c.干燥、称量d.加入足量的 、
、 溶液
溶液
(5)该小组用上述方法测得 产品中
产品中 的质量分数为72.0%,高于理论值。可能原因是
的质量分数为72.0%,高于理论值。可能原因是___________ 。
 和
和 ]为原料制备
]为原料制备 晶体,流程如下:
晶体,流程如下:
已知:氯化时
 与
与 反应生成
反应生成 ,
, 进一步转化生成
进一步转化生成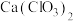 ,少量
,少量 分解生成
分解生成 和
和 。请回答:
。请回答:(1)氯化时装置如图所示,B中的试剂是

(2)下列说法
A.打浆时加水形成石灰浆的目的是使
 与
与 充分反应
充分反应B.氯化时应快速通入氯气以提高氯气的转化率
C.过滤得到的滤渣中含有
 、
、
D.过滤后的滤液中
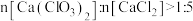
(3)对抽滤后获得的
 晶体进行洗涤的方法是
晶体进行洗涤的方法是(4)某小组认为获得的
 产品中含有KCl、
产品中含有KCl、 两种物质,为测定
两种物质,为测定 的含量,从下列选项中选出合理的操作(操作可以重复使用)并排序:称取mg样品→用蒸馏水溶解→___________→___________→___________→___________→___________→___________→计算,
的含量,从下列选项中选出合理的操作(操作可以重复使用)并排序:称取mg样品→用蒸馏水溶解→___________→___________→___________→___________→___________→___________→计算,a.往滤液中加入足量的
 、
、 溶液b.过滤、洗涤
溶液b.过滤、洗涤c.干燥、称量d.加入足量的
 、
、 溶液
溶液(5)该小组用上述方法测得
 产品中
产品中 的质量分数为72.0%,高于理论值。可能原因是
的质量分数为72.0%,高于理论值。可能原因是
您最近半年使用:0次
10 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
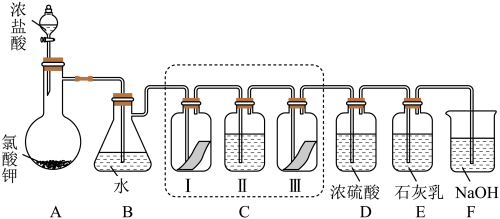
(1)写出B装置中反应的离子方程式_______ 。实验结束后,立即将B中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是_______ (填编号)。
(3)F 装置的作用是(用离子方程式表示)_______
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为_______ (用含 a、b 的式子表示)。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)写出B装置中反应的离子方程式
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为
您最近半年使用:0次



