名校
解题方法
1 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:装置A中反应为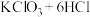 (浓)
(浓)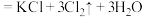 ;
;
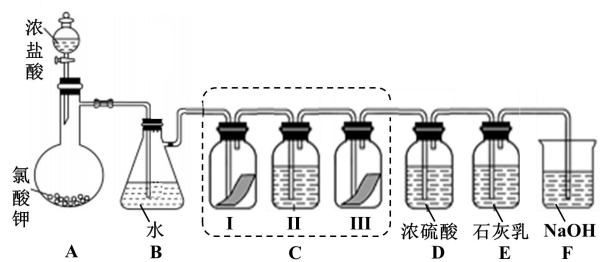
(1)写出B装置中反应的化学方程式_______ 。实验结束后,立即将B中溶液滴几滴在 试纸上,可观察到的现象是
试纸上,可观察到的现象是_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质正确的是_______。
①干燥的有色布条②湿润的有色布条③浓硫酸④碱石灰(固体氢氧化钠和氧化钙组成的混合物)
(3)氯水具有漂白性,将氯水制成漂白粉的主要目的是_______(填标号)。
(4)F装置的作用是_______ ,盛放的试剂是_______ 。
(5)为测定E中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 至产生沉淀最大值时,该过程的化学方程式为
至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
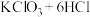 (浓)
(浓)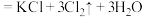 ;
;
(1)写出B装置中反应的化学方程式
 试纸上,可观察到的现象是
试纸上,可观察到的现象是(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质正确的是_______。
①干燥的有色布条②湿润的有色布条③浓硫酸④碱石灰(固体氢氧化钠和氧化钙组成的混合物)
| A.①④② | B.①③② | C.②③① | D.②④① |
| A.增强漂白能力和消毒能力 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白消毒 |
(5)为测定E中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入
 至产生沉淀最大值时,该过程的化学方程式为
至产生沉淀最大值时,该过程的化学方程式为
您最近半年使用:0次
2 . 某化工厂用氯气与石灰乳生产漂白粉.该厂出厂产品说明书如下:

(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的2个化学反应方程式:
①___________________ ;
②_________________ .
(2)某实验室研究员将完全变质后的漂白粉溶于水,往其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为____________ .(假设漂白粉中的其它成份不与稀硝酸反应)

(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的2个化学反应方程式:
①
②
(2)某实验室研究员将完全变质后的漂白粉溶于水,往其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
您最近半年使用:0次
名校
解题方法
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
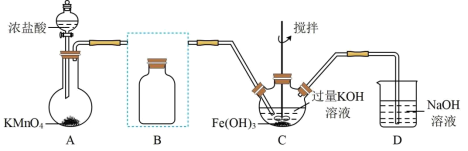
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
4 . 含氯消毒剂、医用酒精、过氧化物等均能有效灭活病毒,为抗击新型冠状肺炎(COVID-19)作出了贡献。请回答下列问题:
(1)下列物质用作消毒剂时,原理与其它不同的是___________ (填字母)。
A.NaClO B.ClO2 C.医用酒精 D.H2O2
(2)兴趣小组欲探究过氧化钠样品是否变质,进行下列操作:取少量样品,溶解,加入___________ ,振荡,有白色沉淀产生,证明Na2O2已变质。
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与Cl2O按一定比例混合后在NaOH溶液中反应制得。
①NaClO2中氯元素的化合价是___________ 。
②制备时Cl2O与ClO2完全反应的物质的量理论比为___________ 。
(4)兴趣小组设计如下图实验装置制取少量漂白液

①MnO2与浓盐酸反应的离子方程式为___________ 。
②充分反应后,测得漂白液中NaClO质量分数偏低。经分析可能的原因有:
I.___________ (用文字简述)。
Ⅱ.氯气与NaOH反应放热,温度较高时生成NaClO3,该反应方程式为___________ 。
(1)下列物质用作消毒剂时,原理与其它不同的是
A.NaClO B.ClO2 C.医用酒精 D.H2O2
(2)兴趣小组欲探究过氧化钠样品是否变质,进行下列操作:取少量样品,溶解,加入
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与Cl2O按一定比例混合后在NaOH溶液中反应制得。
①NaClO2中氯元素的化合价是
②制备时Cl2O与ClO2完全反应的物质的量理论比为
(4)兴趣小组设计如下图实验装置制取少量漂白液

①MnO2与浓盐酸反应的离子方程式为
②充分反应后,测得漂白液中NaClO质量分数偏低。经分析可能的原因有:
I.
Ⅱ.氯气与NaOH反应放热,温度较高时生成NaClO3,该反应方程式为
您最近半年使用:0次
5 . 含氯消毒剂、医用酒精、过氧化物等均能有效灭活病毒,为抗击新型冠状肺炎 (COVID-19)作出了贡献。请回答下列问题∶
(1)下列物质用作消毒剂时,原理与其它不同的是___________ (填字母)。
A. NaClO B. ClO2 C. 医用酒精 D. H2O2
(2)兴趣小组欲探究过氧化钠样品是否变质,进行下列操作∶取少量样品,溶解,加入_________ ,振荡,有白色沉淀产生,证明 Na2O2已变质。
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与Cl2O按一定比例混合后在NaOH溶液中反应制得。
① NaClO2中氯元素的化合价是___________ 。
② 制备时 Cl2O 与 ClO2完全反应的物质的量理论比为___________ 。
③ 在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内将其氧化为ClO2.当消耗标准状况下 1.12 L Cl2时,可制得 ClO2___________ g。
(4)兴趣小组设计如下图实验装置制取少量漂白液。
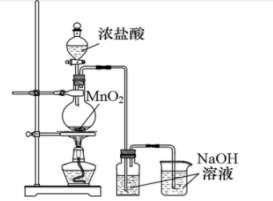
① MnO2与浓 HCl 反应的离子方程式为___________ 。
② 充分反应后,测得漂白液中NaClO质量分数偏低。经分析可能的原因有∶
I.___________ (用文字简述)。
Ⅱ.氯气与NaOH反应放热,温度较高时生成NaClO3,该反应方程式为___________ 。
(1)下列物质用作消毒剂时,原理与其它不同的是
A. NaClO B. ClO2 C. 医用酒精 D. H2O2
(2)兴趣小组欲探究过氧化钠样品是否变质,进行下列操作∶取少量样品,溶解,加入
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与Cl2O按一定比例混合后在NaOH溶液中反应制得。
① NaClO2中氯元素的化合价是
② 制备时 Cl2O 与 ClO2完全反应的物质的量理论比为
③ 在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内将其氧化为ClO2.当消耗标准状况下 1.12 L Cl2时,可制得 ClO2
(4)兴趣小组设计如下图实验装置制取少量漂白液。

① MnO2与浓 HCl 反应的离子方程式为
② 充分反应后,测得漂白液中NaClO质量分数偏低。经分析可能的原因有∶
I.
Ⅱ.氯气与NaOH反应放热,温度较高时生成NaClO3,该反应方程式为
您最近半年使用:0次
2021-02-22更新
|
206次组卷
|
2卷引用:江苏省海安市2020-2021学年高一上学期期末考试化学试题
解题方法
6 . 2020年新冠肺炎(COVID-19)疫情肆虐全球,含氯消毒剂、过氧化物等均能有效灭活病毒。请回答下列问题:
(1)下列消毒剂中,被称为绿色氧化剂的是_______ (填序号)。
A. B.
B.  C.
C. 
(2) 保存不当会变质生成
保存不当会变质生成 ,某兴趣小组为了探究过氧化钠样品是否变质进行如下操作:取少量样品,用蒸馏水溶解,加入
,某兴趣小组为了探究过氧化钠样品是否变质进行如下操作:取少量样品,用蒸馏水溶解,加入 溶液,振荡,
溶液,振荡,_______ (填现象),证明 已变质;否则,
已变质;否则, 未变质。
未变质。
(3)某兴趣小组设计如图所示实验装置制取少量漂白液。
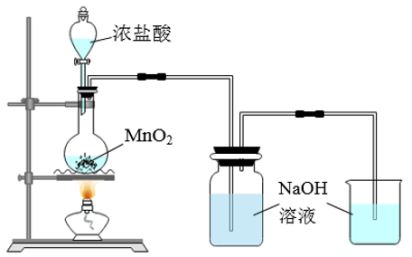
①写出制取漂白液反应的离子方程式:_______ 。
②此实验所得漂白液的有效成分 含量偏低,该小组经分析并查阅资料发现,主要原因是还存在两个副反应:一个副反应是氯气与
含量偏低,该小组经分析并查阅资料发现,主要原因是还存在两个副反应:一个副反应是氯气与 溶液反应放热,温度较高时生成
溶液反应放热,温度较高时生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ ;另一个副反应是_______ (写化学方程式)。
(1)下列消毒剂中,被称为绿色氧化剂的是
A.
 B.
B.  C.
C. 
(2)
 保存不当会变质生成
保存不当会变质生成 ,某兴趣小组为了探究过氧化钠样品是否变质进行如下操作:取少量样品,用蒸馏水溶解,加入
,某兴趣小组为了探究过氧化钠样品是否变质进行如下操作:取少量样品,用蒸馏水溶解,加入 溶液,振荡,
溶液,振荡, 已变质;否则,
已变质;否则, 未变质。
未变质。(3)某兴趣小组设计如图所示实验装置制取少量漂白液。

①写出制取漂白液反应的离子方程式:
②此实验所得漂白液的有效成分
 含量偏低,该小组经分析并查阅资料发现,主要原因是还存在两个副反应:一个副反应是氯气与
含量偏低,该小组经分析并查阅资料发现,主要原因是还存在两个副反应:一个副反应是氯气与 溶液反应放热,温度较高时生成
溶液反应放热,温度较高时生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是
您最近半年使用:0次
解题方法
7 . 某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示。请回答下列问题:
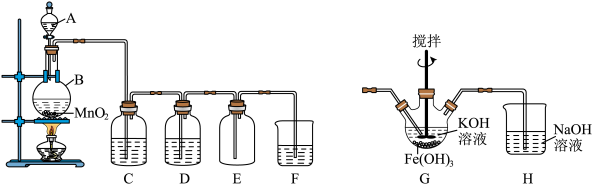
(1)仪器A的名称是___________ ,该反应原理用离子反应方程表示为___________ 。
(2)装置C内盛放的试剂是___________ 。
(3)D中溶液的作用是___________ 。
(4)F装置吸收氯气,可得漂白液的有效成分:___________ (填化学式);漂白粉长时间暴露在空气中会变质,请结合化学方程式解释其原因:___________ 。
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是___________ (填化学式)。
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移___________ 个电子。则G装置中的反应化学方程式为___________ 。

(1)仪器A的名称是
(2)装置C内盛放的试剂是
(3)D中溶液的作用是
(4)F装置吸收氯气,可得漂白液的有效成分:
(5)反应结束后,能证明仪器B内的溶液中含有Cl-的试剂是
(6)高铁酸钾(K2FeO4)是一种高效低污染的水处理剂,其制备原理是将B中产生的Cl2通入G装置,产物有K2FeO4、KCl和H2O。若消耗3个Cl2分子,共转移
您最近半年使用:0次
名校
8 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近半年使用:0次
9 . Cl2和“84”消毒液在三年的防疫工作中,起到了重大的作用。
Ⅰ.Cl2的性质及制备原理探究。
(1)下列关于氯气的说法不正确的是_____ 。
(2)制备氯气的反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的H2体积,计算余下的盐酸的浓度。装置如图所示(夹持器具已略去)。
MnCl2+Cl2↑+2H2O,会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的H2体积,计算余下的盐酸的浓度。装置如图所示(夹持器具已略去)。

①仪器a的名称为_____ 。
②在记录量气管读数时,应注意将_____ (填具体操作,下同),再_____ ,视线与量气管内凹液面相切,水平读数。
③若取制取氯气后的残余溶液10mL与足量的锌粒反应,最终量气筒内收集到的气体折算到标况下为336mL,这说明当盐酸的浓度小于_____ mol/L时不再与二氧化锰反应。
Ⅱ.“84”消毒液是家居常用的防疫用品。
(3)消毒效率是用单位质量的消毒剂得电子数来表示的,NaClO作消毒剂时和氯气一样,还原产物均为Cl-。NaClO的消毒效率是氯气的_____ 倍(保留小数点后两位)。
(4)久置后的“84”消毒液会变质,用离子方程式解释原因:_____ (已知酸性:H2CO3>HClO>HCO )。
)。
(5)针对不同物品的消毒,“84”消毒液需要稀释到不同的浓度。取含次氯酸钠14.9g·L-1的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_____ mol·L-1。
Ⅰ.Cl2的性质及制备原理探究。
(1)下列关于氯气的说法不正确的是
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气光照爆炸后生成的氯化氢溶于水制取盐酸 |
 MnCl2+Cl2↑+2H2O,会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的H2体积,计算余下的盐酸的浓度。装置如图所示(夹持器具已略去)。
MnCl2+Cl2↑+2H2O,会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的H2体积,计算余下的盐酸的浓度。装置如图所示(夹持器具已略去)。
①仪器a的名称为
②在记录量气管读数时,应注意将
③若取制取氯气后的残余溶液10mL与足量的锌粒反应,最终量气筒内收集到的气体折算到标况下为336mL,这说明当盐酸的浓度小于
Ⅱ.“84”消毒液是家居常用的防疫用品。
(3)消毒效率是用单位质量的消毒剂得电子数来表示的,NaClO作消毒剂时和氯气一样,还原产物均为Cl-。NaClO的消毒效率是氯气的
(4)久置后的“84”消毒液会变质,用离子方程式解释原因:
 )。
)。(5)针对不同物品的消毒,“84”消毒液需要稀释到不同的浓度。取含次氯酸钠14.9g·L-1的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近半年使用:0次
10 . 高铁酸钾(K2FeO4)是一种高效无毒的新型绿色消毒剂,制备流程如下:
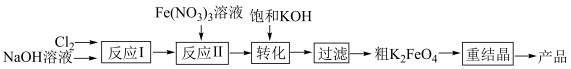
资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ. 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定
(1)K2FeO4具有强氧化性,其中铁元素的化合价为_____ 价。
(2)反应I目的是制备NaClO,请写出其反应化学方程式___________ 。
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为________ (写化学式),生产1mol Na2FeO4转移的电子数为___ NA。
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式_______ 。
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用_______ (选“乙醇”或“水”)洗涤、干燥,可得纯度较高的K2FeO4。
(6)K2FeO4与稀硫酸反应:4 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
_______ (列出计算式即可)。 (物质的纯度
(物质的纯度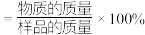 )
)

资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ.
 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定(1)K2FeO4具有强氧化性,其中铁元素的化合价为
(2)反应I目的是制备NaClO,请写出其反应化学方程式
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用
(6)K2FeO4与稀硫酸反应:4
 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
 (物质的纯度
(物质的纯度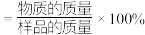 )
)
您最近半年使用:0次



