名校
1 . 氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
Ⅰ.黄色气体 是一种新型消毒剂,可用于污水杀菌和饮用水净化。
是一种新型消毒剂,可用于污水杀菌和饮用水净化。
(1) 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,则该反应的离子方程式为
,则该反应的离子方程式为________ 。
Ⅱ.某学生设计如图所示的实验装置,利用 制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(2)装置 中反应的化学方程式为
中反应的化学方程式为___________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ 。
②试判断另一个副反应(用化学方程式表示)________ ,为避免此副反应的发生,可将装置作何改进________ 。
Ⅰ.黄色气体
 是一种新型消毒剂,可用于污水杀菌和饮用水净化。
是一种新型消毒剂,可用于污水杀菌和饮用水净化。(1)
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,则该反应的离子方程式为
,则该反应的离子方程式为Ⅱ.某学生设计如图所示的实验装置,利用
 制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
(2)装置
 中反应的化学方程式为
中反应的化学方程式为(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②试判断另一个副反应(用化学方程式表示)
您最近半年使用:0次
名校
2 . Ⅰ.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
(1)NaClO中Cl的化合价为___________ ,有较强的___________ (填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式___________ 。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO ,此反应的离子方程式
,此反应的离子方程式___________ 。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为___________ 。
Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(3)另一种制氯气的方法是用固体高锰酸钾与浓盐酸,在常温条件下制取氯气,写出化学反应方程式___________ ;
(4)C装置的作用是___________ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是___________ 。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进___________ 。
(1)NaClO中Cl的化合价为
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO
 ,此反应的离子方程式
,此反应的离子方程式②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(3)另一种制氯气的方法是用固体高锰酸钾与浓盐酸,在常温条件下制取氯气,写出化学反应方程式
(4)C装置的作用是
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进
您最近半年使用:0次
名校
解题方法
3 . 二氯化二硫( )在工业上用于橡胶的硫化。为在实验室合成
)在工业上用于橡胶的硫化。为在实验室合成 ,某化学研究学习小组查阅了相关资料,得到信息:
,某化学研究学习小组查阅了相关资料,得到信息:
①将干燥的氯气在110∼140°C与硫反应,即可得 粗品。
粗品。
②相关物质的部分性质如下表:
设计实验装置图如图所示:

(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见:_____ 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)D中的试剂是_____ 。
(3)仪器B的名称是_____ 。
(4)B中反应的离子方程式:_____ ,E中反应的化学方程式:_____ 。
(5)如果在加热E时温度过高,对实验结果的影响是_____ 。
(6) 粗品中可能混有的杂质是
粗品中可能混有的杂质是 、S,为了提高
、S,为了提高 的纯度,关键的操作是控制好温度和
的纯度,关键的操作是控制好温度和_____ 。
(7)装置H中盛有NaOH溶液,其作用是_____ ,发生反应的化学方程式为_____ 。
 )在工业上用于橡胶的硫化。为在实验室合成
)在工业上用于橡胶的硫化。为在实验室合成 ,某化学研究学习小组查阅了相关资料,得到信息:
,某化学研究学习小组查阅了相关资料,得到信息:①将干燥的氯气在110∼140°C与硫反应,即可得
 粗品。
粗品。②相关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | / |
 | -77 | 137 | 遇水生成HCl、 、S;300℃以上完全分解; 、S;300℃以上完全分解; |

(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见:
利用改进后的正确装置进行实验,请回答下列问题:
(2)D中的试剂是
(3)仪器B的名称是
(4)B中反应的离子方程式:
(5)如果在加热E时温度过高,对实验结果的影响是
(6)
 粗品中可能混有的杂质是
粗品中可能混有的杂质是 、S,为了提高
、S,为了提高 的纯度,关键的操作是控制好温度和
的纯度,关键的操作是控制好温度和(7)装置H中盛有NaOH溶液,其作用是
您最近半年使用:0次
解题方法
4 . Ⅰ.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)Ca(ClO)2中Cl的化合价为___________ ,Ca(ClO)2具有较强的_________ (填“氧化”或“还原”)性,是常用的漂白粉的有效成分。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,该反应的离子方程式为:
,该反应的离子方程式为:___________ 。
②NaClO可将酸性废水中的Fe2+氧化为Fe3+,本身被还原为NaCl,该反应过程中氧化剂与还原剂的物质的量之比为___________ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题(消石灰为氢氧化钙):
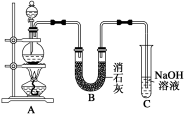
(3)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式:___ 。
(4)C装置的作用是(用离子方程式表示)_____________ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U型管置于________ 中(填“冰水浴还是热水浴”)。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,装置的改进措施为______ 。
(1)Ca(ClO)2中Cl的化合价为
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,该反应的离子方程式为:
,该反应的离子方程式为:②NaClO可将酸性废水中的Fe2+氧化为Fe3+,本身被还原为NaCl,该反应过程中氧化剂与还原剂的物质的量之比为
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题(消石灰为氢氧化钙):

(3)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式:
(4)C装置的作用是(用离子方程式表示)
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U型管置于
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,装置的改进措施为
您最近半年使用:0次
名校
5 . 碘化钠是一种常用的分析试剂,也可用于医疗和照相业。某公司申请了专利:以NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备。反应原理为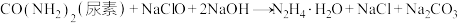 。
。
①制备次氯酸钠和氢氧化钠混合液的相关装置如下:

i.按气流方向,用接口字母表示装置的连接顺序为___________ 。
ii.装置B中盛装的试剂是___________ ,装置D的作用是___________ 。
iii.若该实验温度控制不当,反应后测得三颈瓶内ClO-与 的物质的量之比为4:1,则氯气与氢氧化钠反应的离子方程式为
的物质的量之比为4:1,则氯气与氢氧化钠反应的离子方程式为___________ 。
②为提高水合肼的产率,应采取的操作是___________ (填字母)。
A.缓慢滴加
B.快速滴加
C.将尿素溶液滴入NaClO溶液中
D.将NaClO溶液滴入尿素溶液中
(2)碘化钠的制备。采用水合肼还原法制取碘化钠固体,其制备流程如图所示。
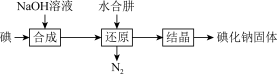
还原过程中,水合肼的作用是除去合成过程中的副产物 ,则合成时产生的I-和
,则合成时产生的I-和 的物质的量之比是
的物质的量之比是___________ 。工业上也可以用硫化钠或铁屑还原 ,但水合肼还原法制得的产品纯度更高,其原因是
,但水合肼还原法制得的产品纯度更高,其原因是___________ 。
(1)水合肼的制备。反应原理为
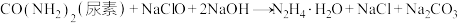 。
。①制备次氯酸钠和氢氧化钠混合液的相关装置如下:

i.按气流方向,用接口字母表示装置的连接顺序为
ii.装置B中盛装的试剂是
iii.若该实验温度控制不当,反应后测得三颈瓶内ClO-与
 的物质的量之比为4:1,则氯气与氢氧化钠反应的离子方程式为
的物质的量之比为4:1,则氯气与氢氧化钠反应的离子方程式为②为提高水合肼的产率,应采取的操作是
A.缓慢滴加
B.快速滴加
C.将尿素溶液滴入NaClO溶液中
D.将NaClO溶液滴入尿素溶液中
(2)碘化钠的制备。采用水合肼还原法制取碘化钠固体,其制备流程如图所示。

还原过程中,水合肼的作用是除去合成过程中的副产物
 ,则合成时产生的I-和
,则合成时产生的I-和 的物质的量之比是
的物质的量之比是 ,但水合肼还原法制得的产品纯度更高,其原因是
,但水合肼还原法制得的产品纯度更高,其原因是
您最近半年使用:0次
2023-10-08更新
|
37次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期10月月考化学试题
6 . 化学与生活密切相关,下列有关物质叙述正确的是
| A.过氧化钠是碱性氧化物,可以用来杀菌消毒 |
| B.碳酸钠在医疗上是治疗胃酸过多的一种药剂 |
| C.工业上通常以氯气和澄清石灰水为原料制造漂白粉 |
| D.氯气有毒,但可用于药物的合成 |
您最近半年使用:0次
7 . 碱式次氯酸镁[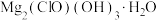 ]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
(1)工业上利用 、NaOH、
、NaOH、 为原料合成碱式次氯酸镁,写出发生反应的化学方程式
为原料合成碱式次氯酸镁,写出发生反应的化学方程式_______ 。
(2)碱式次氯酸镁也可通过电解法制备,在无隔膜状况下以铁为阴极、 为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是
为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是_______ ,阴极电极反应方程式为_______ 。
(3)碱式次氯酸镁经醋酸酸化后杀菌功能增强,原因是_______ (用离子方程式表示)。
(4)碱式次氯酸镁( )的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用
)的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用 标准溶液测定生成的
标准溶液测定生成的 ,将碘单质折算为
,将碘单质折算为 ,有效氯含量
,有效氯含量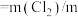 (样品)。则产品的理论有效氯含量为
(样品)。则产品的理论有效氯含量为_______ 。
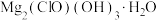 ]微溶于水,是一种有开发价值的无机抗菌剂。请回答:
]微溶于水,是一种有开发价值的无机抗菌剂。请回答:(1)工业上利用
 、NaOH、
、NaOH、 为原料合成碱式次氯酸镁,写出发生反应的化学方程式
为原料合成碱式次氯酸镁,写出发生反应的化学方程式(2)碱式次氯酸镁也可通过电解法制备,在无隔膜状况下以铁为阴极、
 为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是
为阳极电解氯化镁溶液制得。采取无隔膜工艺的目的是(3)碱式次氯酸镁经醋酸酸化后杀菌功能增强,原因是
(4)碱式次氯酸镁(
 )的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用
)的品质可通过其中的有效氯含量来衡量,测定有效氯的方法是:称取一定质量的样品,加入适量乙酸和KI溶液溶解,再用 标准溶液测定生成的
标准溶液测定生成的 ,将碘单质折算为
,将碘单质折算为 ,有效氯含量
,有效氯含量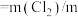 (样品)。则产品的理论有效氯含量为
(样品)。则产品的理论有效氯含量为
您最近半年使用:0次
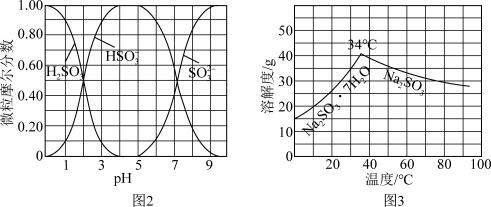
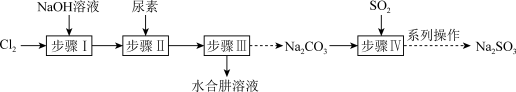
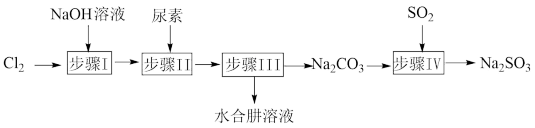
8 . 以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4∙H2O (水合肼)和无水Na2SO3,NaHSO3水溶液中含硫微粒随 的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
已知:
①Cl2+2OH-=Cl-+ClO-+H2O是放热反应,超过40℃发生副反应。
②N2H4∙H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ用Cl2通入NaOH溶液制备NaClO溶液,Cl2需要缓慢通入的原因:_________________
(2)步骤Ⅱ合成N2H4∙H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应,使用冷凝管和迅速升温的目的分别是:__________

(3)关于实验操作下列说法正确的是______________。
(4)请补充完整由NaHSO3溶液制备较纯的无水Na2SO3的实验方案:
边搅拌边向NaHSO3溶液中滴加NaOH溶液→_______ →_______ →_______ 用少量无水乙醇洗涤、干燥,包装。
a.调节 至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
e.蒸发浓缩至有晶膜产生,冷却结晶 f.调节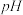 至7
至7
(5)①经某学习小组测定,Na2SO3中含有NaCl杂质,试分析杂质产生的原因:________
②产品的纯度是产品质量的重要指标,该小组同学利用cmol/L的KMnO4测定产品中Na2SO3的含量,装置如图,当酸性KMnO4与Na2SO3恰好完全反应时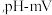 计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化
计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化 ):
):
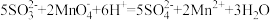
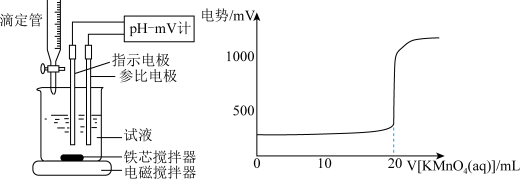
具体流程如下:称量ag样品,加入煮沸后冷却的蒸馏水溶解,配制为250mL的溶液,用碱式滴定管取25.00mL样品溶液于烧杯中,用cmol/L的KMnO4滴定,滴定曲线如图。则样品中Na2SO3纯度的表达式为:________________
 的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:

已知:
①Cl2+2OH-=Cl-+ClO-+H2O是放热反应,超过40℃发生副反应。
②N2H4∙H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ用Cl2通入NaOH溶液制备NaClO溶液,Cl2需要缓慢通入的原因:
(2)步骤Ⅱ合成N2H4∙H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应,使用冷凝管和迅速升温的目的分别是:

(3)关于实验操作下列说法正确的是______________。
| A.步骤Ⅱ中通过滴液漏斗滴加NaClO溶液 |
| B.步骤Ⅲ为了得到较高浓度的水合肼,可以向水合肼溶液中加入NaOH,减压蒸馏 |
| C.步骤Ⅳ中边搅拌边向Na2CO3溶液中通入SO2至pH约为4时,即可以停止通入SO2 |
| D.为了快速得到无水Na2CO3,可以将产品烘干 |
边搅拌边向NaHSO3溶液中滴加NaOH溶液→
a.调节
 至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出e.蒸发浓缩至有晶膜产生,冷却结晶 f.调节
 至7
至7(5)①经某学习小组测定,Na2SO3中含有NaCl杂质,试分析杂质产生的原因:
②产品的纯度是产品质量的重要指标,该小组同学利用cmol/L的KMnO4测定产品中Na2SO3的含量,装置如图,当酸性KMnO4与Na2SO3恰好完全反应时
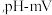 计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化
计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化 ):
):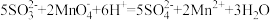

具体流程如下:称量ag样品,加入煮沸后冷却的蒸馏水溶解,配制为250mL的溶液,用碱式滴定管取25.00mL样品溶液于烧杯中,用cmol/L的KMnO4滴定,滴定曲线如图。则样品中Na2SO3纯度的表达式为:
您最近半年使用:0次
9 . 以Cl2、NaOH、CO(NH2)2(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应;②N2H4·H2O沸点约118°C,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I为制备NaClO溶液,若温度超过40°C,则Cl2与NaOH溶液反应生成NaClO3和NaCl。该反应的离子方程式为_______ ;实验中为避免反应过于剧烈,放出大量的热而导致温度升高,副反应加剧,除可以用冰水浴控制温度外,还可以采取的措施为_______ 。
(2)步骤II为合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40°C以下反应一段时间后,再迅速升温至110°C继续反应。
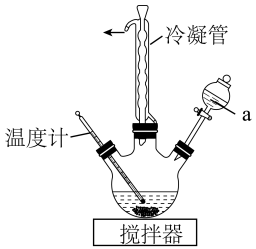
①图1中仪器a的名称为_______ ,其盛装的溶液是_______ [填“NaClO碱性溶液”或“CO(NH2)2水溶液”]。
②写出合N2H4·H2O发生的反应的离子方程式:_______ ;使用冷凝管的目的是_______ 。
(3)步骤IV为用步骤III得到的副产品Na2CO3溶液制备无水Na2SO3(已知水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的实验操作为_______ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为_______ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_______ °C条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封保存。

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应;②N2H4·H2O沸点约118°C,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I为制备NaClO溶液,若温度超过40°C,则Cl2与NaOH溶液反应生成NaClO3和NaCl。该反应的离子方程式为
(2)步骤II为合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40°C以下反应一段时间后,再迅速升温至110°C继续反应。

①图1中仪器a的名称为
②写出合N2H4·H2O发生的反应的离子方程式:
(3)步骤IV为用步骤III得到的副产品Na2CO3溶液制备无水Na2SO3(已知水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近半年使用:0次
解题方法
10 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_______ ;实验中控制温度除用冰水浴外,还缓慢通入Cl2,其理由是________ 。
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为______ ;使用冷凝管的目的是_______ 。

(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3(水溶搅拌器液中H2SO3, ,
, 随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
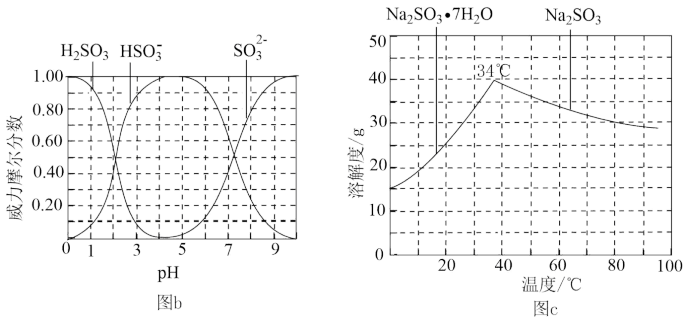
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验方案为___________ 。
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为________ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_________ ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为

(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3(水溶搅拌器液中H2SO3,
 ,
, 随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验方案为
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近半年使用:0次



