解题方法
1 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
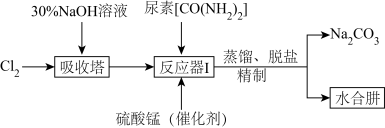
Ⅱ.下图为实验室模拟尿素法制备水合肼(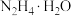 )的流程图:
)的流程图:
已知:①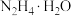 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成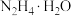 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
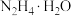 )的流程图:
)的流程图:
已知:①
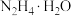 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
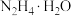 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近一年使用:0次
2 . 某化学研究性学习小组以干燥、纯净的 和铁粉为原料,模拟工业制备无水
和铁粉为原料,模拟工业制备无水 ,装置如图。
,装置如图。
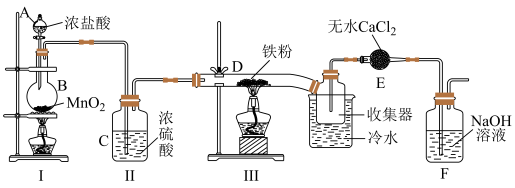
经查阅资料得知:无水 在潮湿环境中易潮解:加热易升华,遇冷易凝华。
在潮湿环境中易潮解:加热易升华,遇冷易凝华。
(1)Ⅰ中装置A的名称___________ ,烧瓶B中发生反应的离子方程式为:___________ 。
(2)开始实验时,先点燃装置___________ (填Ⅰ或Ⅲ)处酒精灯,再点燃另一处酒精灯:上述装置中有一处明显的缺陷,如何改进___________ 。
(3)E装置的作用是___________ ,F中发生反应的离子方程式___________ 。
(4)取少许产品溶于蒸馏水,静置后,向上层清液中滴加KSCN溶液,溶液不变红,产生此现象的可能原因___________ (请用必要的文字或化学方程式解释)
 和铁粉为原料,模拟工业制备无水
和铁粉为原料,模拟工业制备无水 ,装置如图。
,装置如图。
经查阅资料得知:无水
 在潮湿环境中易潮解:加热易升华,遇冷易凝华。
在潮湿环境中易潮解:加热易升华,遇冷易凝华。(1)Ⅰ中装置A的名称
(2)开始实验时,先点燃装置
(3)E装置的作用是
(4)取少许产品溶于蒸馏水,静置后,向上层清液中滴加KSCN溶液,溶液不变红,产生此现象的可能原因
您最近一年使用:0次
名校
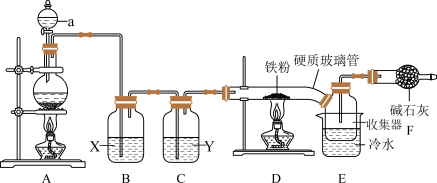
3 .  是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。
回答下列问题:
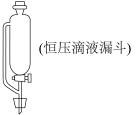
(1)A中发生的化学反应方程式是___________ 。为使实验顺利进行,可将仪器a更换为恒压滴液漏斗(如上图),更换后优点是___________ 。
(2)试剂“X”是___________ ,其作用是___________ 。
(3)硬质玻璃管直接连接收集器的优点___________ 。
(4)实验开始时,应先点燃A处酒精灯,当___________ 时,再点燃D处酒精灯。
(5)装置F作用是吸收多余氯气和___________ ,氯气和碱石灰反应时,若有0.71g氯气被氧化成次氯酸盐,1.42g氯气被氧化成氯酸盐,则被还原的氯原子的物质的量为___________ 。
 是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。

回答下列问题:
(1)A中发生的化学反应方程式是
(2)试剂“X”是
(3)硬质玻璃管直接连接收集器的优点
(4)实验开始时,应先点燃A处酒精灯,当
(5)装置F作用是吸收多余氯气和
您最近一年使用:0次
4 . 某实验小组设计如下装置(夹持装置未画出)模拟工业生产氯水和漂白粉。

(1)气体发生装置A应选用___________ (填“甲”、“乙”或“丙”),反应的化学方程式为___________ 。
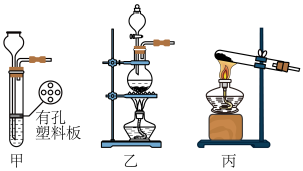
(2)装置B中试剂为___________ 。
(3)制备氯水的装置是___________ (填字母序号)。
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的___________ (写试剂名称);采用多孔球泡而非常规导管导气的原因是___________ 。
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的 稀溶液中,当滴到一定量时,红色突然褪去。
稀溶液中,当滴到一定量时,红色突然褪去。
①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ:___________ 。
②[验证猜想]向褪色后的溶液中滴加___________ ,若溶液变红,则证明猜想Ⅱ正确;反之则猜想Ⅰ正确。

(1)气体发生装置A应选用

(2)装置B中试剂为
(3)制备氯水的装置是
(4)装置D用以制备漂白粉,三颈烧瓶中盛装冷的
(5)探究新制氯水的性质:用胶头滴管将氯水滴加到含有酚酞的
 稀溶液中,当滴到一定量时,红色突然褪去。
稀溶液中,当滴到一定量时,红色突然褪去。①[提出猜想]红色褪去的原因可能有两种:
猜想Ⅰ:氯水具有漂白性;
猜想Ⅱ:
②[验证猜想]向褪色后的溶液中滴加
您最近一年使用:0次
名校
5 . 寒冬袭来,病毒肆虐,含氯消毒剂在控制病原微生物污染和传播等方面有着重要作用。某校课外化学小组设计如图所示装置制备少量氯气并进行系列实验(夹持仪器已略)。
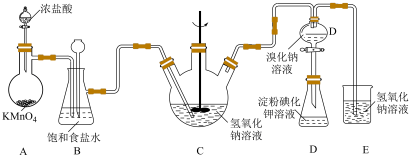
已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
(1)请写出实验室用 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式___________ ;
(2)装置B的作用是___________ ;
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出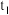 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式___________ ;
(4)设计装置D、E的目的是验证氧化性 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为___________ 色,若打开装置D的活塞,使D中溶液滴入装置E,可以观察到的现象是___________ ,经认真考虑,有同学提出该实验方案仍有不足,你若同意该建议,请说明其中不足的原因是___________ ;(若不同意,则该空不用写)
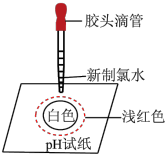
(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
| 卤素单质 |  |  |  |
| 水溶液颜色 | 黄绿色 | 橙黄色 | 棕黄色 |
(1)请写出实验室用
 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式(2)装置B的作用是
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出
 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式
(4)设计装置D、E的目的是验证氧化性
 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

A.该实验说明 分子具有漂白性 分子具有漂白性 |
B.该实验说明 扩散速率比HClO分子快 扩散速率比HClO分子快 |
| C.将实验后变白的pH试纸再滴入盐酸又会变红 |
| D.若用久置的氯水进行实验,现象相同 |
您最近一年使用:0次
2024-01-25更新
|
85次组卷
|
2卷引用:四川省绵阳市绵阳中学2023-2024学年高一上学期期末模拟测试化学试题
6 . 人类对氯的认识经历了漫长的过程。回答下列问题:
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,首次制得Cl2,该反应的离子方程式是___________ 。
(2)1785年,贝托雷最早利用氯气的水溶液做漂白剂,可以永久性地漂白纸张和鲜花,且在阳光下能够分解产生氧气。某实验小组利用如下实验装置探究氯气是否具有漂白性。___________ ,装置接口的连接顺序是a→______→______→______→______→f。___________
②装置乙中的试剂Y是___________ 。
③实验开始后,关闭装置乙中的开关K,观察到干燥有色布条___________ (填“褪色”或“不褪色”);打开开关K,观察到干燥有色布条___________ (填“褪色”或“不褪色”),证明氯气没有漂白性,但氯气与水反应的产物___________ 具有漂白性。
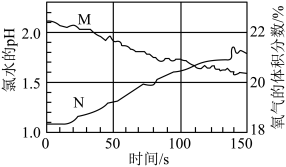
④实验小组利用数字传感器测定广口瓶中的氯水在光照条件下的pH和瓶中氧气的体积分数变化曲线如下图所示,其中表示氯水的pH变化的曲线是___________ (填“M”或“N”),据此分析,此时广口瓶中发生反应的化学方程式是___________ 。___________ 。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,首次制得Cl2,该反应的离子方程式是
(2)1785年,贝托雷最早利用氯气的水溶液做漂白剂,可以永久性地漂白纸张和鲜花,且在阳光下能够分解产生氧气。某实验小组利用如下实验装置探究氯气是否具有漂白性。

②装置乙中的试剂Y是
③实验开始后,关闭装置乙中的开关K,观察到干燥有色布条
④实验小组利用数字传感器测定广口瓶中的氯水在光照条件下的pH和瓶中氧气的体积分数变化曲线如下图所示,其中表示氯水的pH变化的曲线是
您最近一年使用:0次
2024-01-24更新
|
45次组卷
|
2卷引用:四川省凉山州宁南中学2023-2024学年高一上学期期末考试化学模拟试题(一)
名校
解题方法
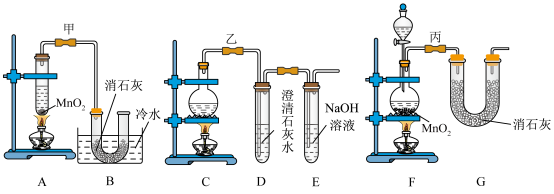
7 . 实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:___________ 。
(2)哪位同学的装置能够有效地防止副反应的发生?___________ 。
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:___________ 。
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)___________ 。
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是___________ (假定各步反应均无反应损耗且无副反应发生)。

(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:
(2)哪位同学的装置能够有效地防止副反应的发生?
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是
您最近一年使用:0次
2024-01-02更新
|
26次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期1月期末化学试题
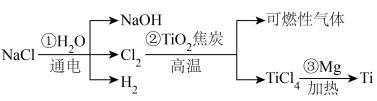
8 . 以 为原料制备
为原料制备 和
和 ,并利用
,并利用 冶炼金属钛(Ti)的工艺流程如下:
冶炼金属钛(Ti)的工艺流程如下:
已知:高温条件下Ti的性质很活泼。
回答下列问题:
(1)在实际生产中,应避免步骤①的产物 与
与 接触发生副反应,降低
接触发生副反应,降低 纯度,解释其原因,用离子方程式表示为
纯度,解释其原因,用离子方程式表示为___________ 。
(2) 在
在 中燃烧的现象是
中燃烧的现象是___________ ,恰好完全反应后,将产物溶于水制得密度为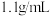 ,质量分数为
,质量分数为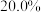 的盐酸溶液,其物质的量浓度为
的盐酸溶液,其物质的量浓度为___________ 。
(3)步骤②发生反应的化学方程式为___________ ,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)步骤③须在稀有气体(如氩)的氛围下进行,稀有气体的作用是___________ 。
 为原料制备
为原料制备 和
和 ,并利用
,并利用 冶炼金属钛(Ti)的工艺流程如下:
冶炼金属钛(Ti)的工艺流程如下:
已知:高温条件下Ti的性质很活泼。
回答下列问题:
(1)在实际生产中,应避免步骤①的产物
 与
与 接触发生副反应,降低
接触发生副反应,降低 纯度,解释其原因,用离子方程式表示为
纯度,解释其原因,用离子方程式表示为(2)
 在
在 中燃烧的现象是
中燃烧的现象是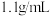 ,质量分数为
,质量分数为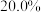 的盐酸溶液,其物质的量浓度为
的盐酸溶液,其物质的量浓度为(3)步骤②发生反应的化学方程式为
(4)步骤③须在稀有气体(如氩)的氛围下进行,稀有气体的作用是
您最近一年使用:0次
解题方法
9 . 某研究小组利用下图装置制备“84”消毒液并探究 的化学性质。已知:
的化学性质。已知: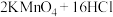 (浓)
(浓)
回答下列问题:
(1)盛装 的仪器名称是
的仪器名称是_______ ,本实验制备 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是______ (填“提高”“降低”或“无影响”),向制得的“84”消毒液中加入较多硫酸时会产生氯气,发生反应的离子方程式为______ 。
(3)D中可观察到的现象是_______ ,说明溶液中存在的微粒有_______ 。
(4)从环保角度考虑,对本实验装置的改进措施是_______ 。
(5)已知,还原性: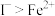 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
 的化学性质。已知:
的化学性质。已知: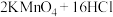 (浓)
(浓)

回答下列问题:
(1)盛装
 的仪器名称是
的仪器名称是 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是
(3)D中可观察到的现象是
(4)从环保角度考虑,对本实验装置的改进措施是
(5)已知,还原性:
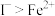 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
| 实验步骤 | 现象 |
| ①向甲试管中滴加淀粉溶液 | |
| ②向乙试管中滴加 |
您最近一年使用:0次
2023-02-18更新
|
180次组卷
|
2卷引用:四川省绵阳市2022-2023学年高一上学期期末考试化学试题
名校
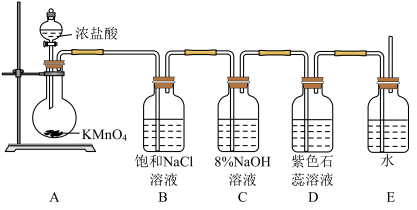
10 . 已知KMnO4在常温下与浓盐酸迅速反应生成Cl2,某兴趣小组设计下图装置用NaOH溶液吸收Cl2制得漂白液并探究NaClO的性质。
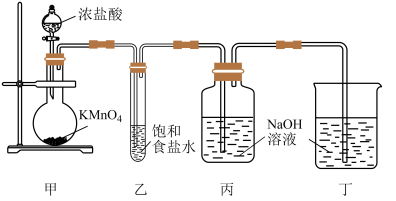
(1)甲装置中发生反应的离子方程式为_______ 。
(2)乙装置的作用为_______ 。
(3)丙装置中发生反应的离子方程式为_______ 。
(4)为探究NaClO溶液的性质,某兴趣小组进行以下实验:
i.取丙中溶液于试管中,滴入几滴紫色石蕊试液,溶液变蓝。
ii.将步骤i中蓝色溶液滴入浓盐酸中,蓝色迅速褪去,同时产生少量黄绿色气体。
iii.取丙中溶液于试管中,滴入稀H2SO4溶液,光照,产生无色气泡。
iv.取丙中溶液于试管中,滴入几滴淀粉KI溶液,溶液变蓝。
①步骤ii中蓝色迅速褪去的原因是_______ ;产生黄绿色气体的离子方程式为_______ 。
②步骤iii 中光照产生无色气泡的原因是_______ (用化学方程式表示)。
③步骤iv说明NaClO具有_______ 性。

(1)甲装置中发生反应的离子方程式为
(2)乙装置的作用为
(3)丙装置中发生反应的离子方程式为
(4)为探究NaClO溶液的性质,某兴趣小组进行以下实验:
i.取丙中溶液于试管中,滴入几滴紫色石蕊试液,溶液变蓝。
ii.将步骤i中蓝色溶液滴入浓盐酸中,蓝色迅速褪去,同时产生少量黄绿色气体。
iii.取丙中溶液于试管中,滴入稀H2SO4溶液,光照,产生无色气泡。
iv.取丙中溶液于试管中,滴入几滴淀粉KI溶液,溶液变蓝。
①步骤ii中蓝色迅速褪去的原因是
②步骤iii 中光照产生无色气泡的原因是
③步骤iv说明NaClO具有
您最近一年使用:0次
2023-02-09更新
|
130次组卷
|
5卷引用:四川省泸州市泸县第四中学2023-2024学年高一下学期开学化学试题
四川省泸州市泸县第四中学2023-2024学年高一下学期开学化学试题河南省安阳市重点高中2022-2023学年一下学期开学考试化学试题河南省安阳市第一中学2022-2023学年高一下学期开学考试化学试题河南郑州市2022-2023学年高一下学期开学考试化学试题(已下线)期中测试卷二【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)



