名校
解题方法
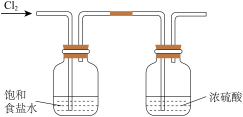
1 . 下列装置和操作不能达到实验目的的是。
|
|
|
|
A.净化浓盐酸与 反应制得的 反应制得的 | B.验证氨气极易溶于水 | C.除去 中的 中的 杂质 杂质 | D.观察浓硝酸与铜反应的现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-03更新
|
727次组卷
|
5卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题6-10)(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题四川省达州市万源中学2023-2024学年高一下学期4月期中考试化学试题
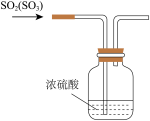
2 . 如下图所示,某同学利用Na2SO3和浓H2SO4制取SO2并探究其性质。

(1)装置A中盛浓硫酸的仪器名称是_______ ,写出装置A中发生反应的化学方程式:_______ 。
(2)装置C中的实验现象是_______ ,该实验现象说明SO2具有_______ 性。
(3)能验证SO2具有酸性氧化物的通性的实验现象是_______ 。
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_______ 。
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
a.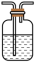 小苏打溶液b.
小苏打溶液b. 品红溶液
品红溶液
c. 酸性KMnO4溶液d.
酸性KMnO4溶液d. 漂白粉溶液
漂白粉溶液
装置的连接顺序为纯净SO2→_______ (选填字母);d中反应的离子方程式为_______ 。

(1)装置A中盛浓硫酸的仪器名称是
(2)装置C中的实验现象是
(3)能验证SO2具有酸性氧化物的通性的实验现象是
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
a.
 小苏打溶液b.
小苏打溶液b. 品红溶液
品红溶液c.
 酸性KMnO4溶液d.
酸性KMnO4溶液d. 漂白粉溶液
漂白粉溶液装置的连接顺序为纯净SO2→
您最近一年使用:0次
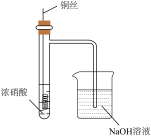
3 . 实验室用浓硫酸、硝酸与铜丝反应探究物质性质和进行物质制备。
(1)回答实验甲问题:
① 试管中发生反应的化学方程式为
试管中发生反应的化学方程式为______ 。
② 中现象说明
中现象说明 具有
具有______ 作用。
③iv中制备 反应的离子方程式为
反应的离子方程式为______ 。
④
 中溶液褪色,说明
中溶液褪色,说明 具有
具有______ 性;B中无明显现象,某同学通过检测 的生成证明
的生成证明 和
和 发生了反应:取
发生了反应:取 中溶液于试管中,
中溶液于试管中,______ (填试剂和操作),产生白色沉淀。
(2)回答实验乙问题:
实验Ⅰ、Ⅱ中的红棕色气体均是 。
。
(1)实验Ⅰ产生 的化学方程式是
的化学方程式是______ 。
(2)实验Ⅱ产生 的化学方程式是
的化学方程式是______ 。
| 实验编号 | 实验目的 | 实验装置 | 操作及现象 |
| 甲 | 用浓硫酸与铜丝加热生成的 制备少量 制备少量 并检验性质 并检验性质 | 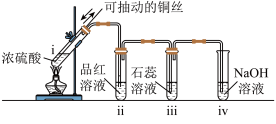 | 点燃酒精灯,i试管中有白雾生成,铜丝表面产生气泡;试管ii中溶液红色褪去,试管iii中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。 |
| 乙 | 探究铜与浓或稀硝酸反应 |  | (I)试剂a为4mL浓硝酸:铜片完全溶解,溶液变绿,出现大量红棕色气体。 (II)试剂a为4mL稀硝酸:铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
①
 试管中发生反应的化学方程式为
试管中发生反应的化学方程式为②
 中现象说明
中现象说明 具有
具有③iv中制备
 反应的离子方程式为
反应的离子方程式为④

 中溶液褪色,说明
中溶液褪色,说明 具有
具有 的生成证明
的生成证明 和
和 发生了反应:取
发生了反应:取 中溶液于试管中,
中溶液于试管中,(2)回答实验乙问题:
实验Ⅰ、Ⅱ中的红棕色气体均是
 。
。(1)实验Ⅰ产生
 的化学方程式是
的化学方程式是(2)实验Ⅱ产生
 的化学方程式是
的化学方程式是
您最近一年使用:0次
4 . 某化学兴趣小组意外获得黄铜矿(主要成分CuFeS2,杂质为SiO2),对其性质产生浓厚的兴趣,经过查阅资料设计了以下实验装置对其进行研究。实验步骤:①组装好仪器,检查装置的气密性良好。②加入药品ag,从左端不断鼓入空气。③点燃B、E处的酒精灯。

请回答下列问题:
(1)仪器A的名称_____ ,A中的试剂是_____ 。
(2)当反应一段时间后,对C溶液(装有品红)进行加热,其现象为_____ 。
(3)已知装置中通入足量的空气,假设E中反应物充分反应,为验证E中反应是可逆反应且验证其产物,F、G、H装置中的溶液可分别选择_____ 。(填序号)
①Na2S溶液、BaCl2溶液、NaOH溶液
②BaCl2溶液、Ba(NO3)2溶液、NaOH溶液
③KMnO4溶液、BaCl2溶液、NaOH溶液
查阅资料:①样品经煅烧后得到的固体可能为泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO)。②Cu2O与稀H2SO4的反应为:Cu2O+H2SO4=Cu+CuSO4+H2O
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。
(4)完成表中横线上的内容。
探究Ⅱ:设计实验方案验证泡铜中是否含有Cu2O?_____ 。
探究Ⅲ:煅烧的固体直接加稀硫酸,以上两个实验都达不到实验目的原因(用离子方程式表示)_____ 。
(5)为测定CuFeS2的纯度,称取ag的黄铜矿样品充分燃烧后,使其气体产物完全溶于C装置(装有足量的H2O2溶液),向C中加入过量的BaCl2溶液振荡且静置,经过滤后处理得到固体为wg,则CuFeS2的纯度为_____ (用含相应字母的代数式表示)(BaSO4的摩尔质量为233g·mol-1)。

请回答下列问题:
(1)仪器A的名称
(2)当反应一段时间后,对C溶液(装有品红)进行加热,其现象为
(3)已知装置中通入足量的空气,假设E中反应物充分反应,为验证E中反应是可逆反应且验证其产物,F、G、H装置中的溶液可分别选择
①Na2S溶液、BaCl2溶液、NaOH溶液
②BaCl2溶液、Ba(NO3)2溶液、NaOH溶液
③KMnO4溶液、BaCl2溶液、NaOH溶液
查阅资料:①样品经煅烧后得到的固体可能为泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO)。②Cu2O与稀H2SO4的反应为:Cu2O+H2SO4=Cu+CuSO4+H2O
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。
(4)完成表中横线上的内容。
| 试样 | 加入试剂及操作 | 实验现象 | 得出结论 | 离子反应方程式 |
| 第一份 | 滴入几滴 | 试剂褪色 | 含FeO | |
| 第二份 | 滴入几滴 | 溶液变为血红色 | 含Fe2O3 |
探究Ⅲ:煅烧的固体直接加稀硫酸,以上两个实验都达不到实验目的原因(用离子方程式表示)
(5)为测定CuFeS2的纯度,称取ag的黄铜矿样品充分燃烧后,使其气体产物完全溶于C装置(装有足量的H2O2溶液),向C中加入过量的BaCl2溶液振荡且静置,经过滤后处理得到固体为wg,则CuFeS2的纯度为
您最近一年使用:0次
解题方法
5 . 根据实验目的,下列实验方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验方案设计 | 现象和结论 |
| A | 制备Fe(OH)3胶体 | 向5 mL NaOH溶液中滴加2滴FeCl3饱和溶液,煮沸 | 溶液变红褐色;说明有Fe(OH)3胶体生成 |
| B | 验证铁的电化学腐蚀 | 在一 块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置2~3 min | 溶液边缘 出现红色;说明铁发生了吸氧腐蚀 |
| C | 探究SO2的还原性 | 将SO2通入适量品红溶液中 | 溶液褪色:说明SO2具有还原性 |
| D | 比较C与Cl的非金属性强弱 | 用pH试纸测定1mol/L的Na2CO3和NaClO溶液的pH | 前者的试纸颜色比后者深; 说明非金属性Cl>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 如下图所示,某同学利用Na2SO3和浓H2SO4制取SO2并探究其性质。

(1)写出装置B中发生反应的离子方程式:___________ 。
(2)装置C中的实验现象是___________ ,该实验现象说明SO2具有___________ 性。
(3)能验证SO2具有酸性氧化物的通性的实验现象是___________ 。
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:___________ 。
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
A. 小苏打溶液B.
小苏打溶液B.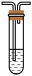 品红溶液C.
品红溶液C.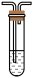 酸性KMnO4溶液D.
酸性KMnO4溶液D.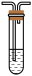 漂白粉溶液
漂白粉溶液
装置的连接顺序为纯净SO2→___________ (选填字母); D中反应的离子方程式为___________ 。

(1)写出装置B中发生反应的离子方程式:
(2)装置C中的实验现象是
(3)能验证SO2具有酸性氧化物的通性的实验现象是
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
A.
 小苏打溶液B.
小苏打溶液B. 品红溶液C.
品红溶液C. 酸性KMnO4溶液D.
酸性KMnO4溶液D. 漂白粉溶液
漂白粉溶液装置的连接顺序为纯净SO2→
您最近一年使用:0次
2023-03-24更新
|
398次组卷
|
2卷引用:河北省石家庄市第二中学西校区2022-2023学年高一下学期3月月考化学试题
名校
解题方法
7 . 根据要求完成下列各小题实验目的。a、b为弹簧夹,(加热及固定装置已略去)
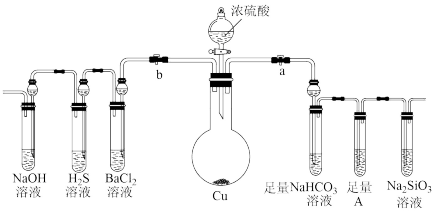
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、_______ 、加药品后,打开a关闭b,打开分液漏斗旋转活塞,然后滴入浓硫酸,发现硫酸滴入几滴,就不再滴下,原因是_______ ,当顺利滴入时加热。
②铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂可以是_______ 。(用a,b,c填空)
a.品红溶液 b.氢氧化钠溶液 c.酸性高锰酸钾溶液
③能说明碳的非金属性比硅强的实验现象是_______ 。
(2)验证 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。
①在(1)操作后打开b,关闭a。
②一段时间后, 溶液中的现象是
溶液中的现象是_______ ,化学方程式是_______ 。
(3) 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、
②铜与浓硫酸反应的化学方程式是
a.品红溶液 b.氢氧化钠溶液 c.酸性高锰酸钾溶液
③能说明碳的非金属性比硅强的实验现象是
(2)验证
 的氧化性、还原性和酸性氧化物的通性。
的氧化性、还原性和酸性氧化物的通性。①在(1)操作后打开b,关闭a。
②一段时间后,
 溶液中的现象是
溶液中的现象是(3)
 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2023-01-21更新
|
371次组卷
|
2卷引用:吉林省长春市第十一高中2022-2023高一上学期期末考试化学试题
解题方法
8 . 如图所示,某同学利用Na2SO3和浓H2SO4制取SO2并探究其性质。
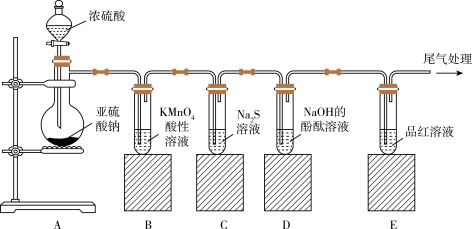
(1)装置A中装浓硫酸的仪器名称:______ 。
(2)装置B中的离子方程式是_____ ,该反应说明SO2具有_____ 性。
(3)装置C中的实验现象是_____ ,该实验现象说明SO2具有_____ 性。
(4)装置E中的现象是_____ ,尾气处理所用的试剂是____ 。
(5)某同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体。可以选择如图洗气装置设计实验:
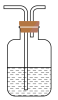
洗气装置中的溶液是。
A.浓硫酸 B.氢氧化钠溶液 C.硫酸铜溶液 D.品红溶液 E.澄清石灰水 F.酸性高锰酸钾溶液 G.碳酸氢钠溶液
为达到实验目的,按气流方向从左到右,上述装置所装试剂的连接顺序是_____ (用字母表示,所给试剂可以重复使用,有些试剂也可以不用)。

(1)装置A中装浓硫酸的仪器名称:
(2)装置B中的离子方程式是
(3)装置C中的实验现象是
(4)装置E中的现象是
(5)某同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体。可以选择如图洗气装置设计实验:

洗气装置中的溶液是。
A.浓硫酸 B.氢氧化钠溶液 C.硫酸铜溶液 D.品红溶液 E.澄清石灰水 F.酸性高锰酸钾溶液 G.碳酸氢钠溶液
为达到实验目的,按气流方向从左到右,上述装置所装试剂的连接顺序是
您最近一年使用:0次
解题方法
9 . 硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有 的硬质玻璃管;
的硬质玻璃管;
③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。
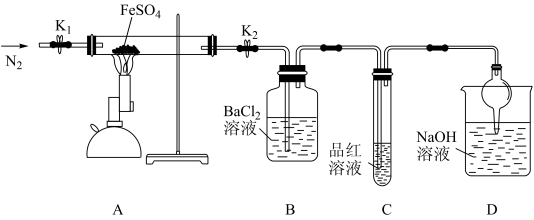
(1)根据B、C装置中的实验现象可推测分解产物中含有_______ 和_______ 。
(2)将装置B、C顺序颠倒能否达到原来的实验目的_______ (填“能”或“不能”),原因是_______ 。
(3)D装置中发生的主要反应的离子方程式是_______ 。
(4)通过计算确定剩余10.88g固体的成分,写出计算过程。______
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有
 的硬质玻璃管;
的硬质玻璃管;③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B、C装置中的实验现象可推测分解产物中含有
(2)将装置B、C顺序颠倒能否达到原来的实验目的
(3)D装置中发生的主要反应的离子方程式是
(4)通过计算确定剩余10.88g固体的成分,写出计算过程。
您最近一年使用:0次
名校
10 . 近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能酸性高锰酸钾液褪色(由紫红色变为无色),请完成该反应的离子方程式:_______
根据上述资料,甲同学和丙学分别实验方案进行探究。
实验探究:甲同学:甲同学进行了如图所示A、B两步实验
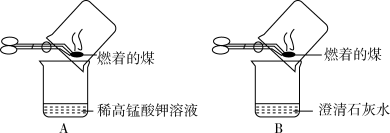
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是_______ 。
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是_______ 。
(4)证明煤中含有碳元素和硫元素的现象_______ 。
(5)装置C中的高锰酸钾溶液可以替换为_______。
(6)煤燃烧会产生含SO2的废气,可以采用“钙基固硫法”解决。即将生石灰与含硫的煤混合后再燃烧,可以将生成的SO2最终转化为CaSO4,请写出该反应化学方程式为_______ 。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能酸性高锰酸钾液褪色(由紫红色变为无色),请完成该反应的离子方程式:
根据上述资料,甲同学和丙学分别实验方案进行探究。
实验探究:甲同学:甲同学进行了如图所示A、B两步实验

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是
(4)证明煤中含有碳元素和硫元素的现象
(5)装置C中的高锰酸钾溶液可以替换为_______。
| A.足量l2的淀粉溶液 | B.足量饱和 NaHCO3溶液 | C.足量Na2SO3溶液. | D.足量溴水 |
您最近一年使用:0次
2022-04-08更新
|
279次组卷
|
3卷引用:广东省广州大学附属中学2021-2022学年高一下学期3月月考化学试题