名校
解题方法
1 . 下列关于SO2的说法不正确的是
| A.工业制备硫酸后含SO2的尾气大量排放至空气中会形成酸雨 |
| B.SO2能使酸性KMnO4溶液褪色,是利用了SO2的还原性 |
| C.SO2与H2S气体混合,产生淡黄色固体,体现了SO2的氧化性 |
| D.SO2通入滴有酚酞的NaOH溶液中,红色褪去,向褪色后的溶液中滴加NaOH溶液,红色复现,体现了SO2的漂白性 |
您最近一年使用:0次
2023-01-12更新
|
1045次组卷
|
8卷引用:江苏省宿迁市泗阳县实验高级中学2022-2023学年高一上学期期末考试化学试题
江苏省宿迁市泗阳县实验高级中学2022-2023学年高一上学期期末考试化学试题(已下线)进阶学习(已下线)热点01 硫及其化合物(已下线)第五章 化工生产中的重要非金属元素新疆兵团第三师图木舒克市鸿德实验学校2022-2023学年高一下学期期中考试化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省苏州实验中学科技城校2023-2024学年高一上学期十二月份质量调研 化学试卷江苏省扬州市邗江区第一中学2023-2024学年高一上学期 12月化学试题
名校
2 . 利用如图可以从不同角度研究含硫物质的性质及其转化关系。
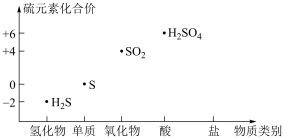
回答下列问题:
(1)H2S与SO2反应的化学方程式为____ ,反应中H2S体现____ (填“氧化性”或“还原性”)。
(2)加热时,浓硫酸与木炭反应的化学方程式为____ ,下列试剂不能用于验证生成物中含有SO2的是____ (填标号)。
a.品红溶液b.酸性KMnO4溶液c.澄清石灰水
(3)SO2的过度排放会引起酸雨,酸雨是指pH<____ 的雨水,其中NOx的排放也会导致酸雨的形成,写出NO2与水反应的化学方程式____ 。
(4)实验室可用碱液吸收法对NOx进行尾气处理,写出NO2与氢氧化钠溶液反应的离子方程式____ 。

回答下列问题:
(1)H2S与SO2反应的化学方程式为
(2)加热时,浓硫酸与木炭反应的化学方程式为
a.品红溶液b.酸性KMnO4溶液c.澄清石灰水
(3)SO2的过度排放会引起酸雨,酸雨是指pH<
(4)实验室可用碱液吸收法对NOx进行尾气处理,写出NO2与氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
3 . 某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2 +2H2O=5
+2H2O=5 +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。

①通入空气前应进行的实验操作是________________________________ ;
②当观察到实验的现象为________________________________________ 时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________ 。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。

①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________ ;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________ 。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
①_____________________________________________________ ;
②_____________________________________________________ 。
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2
 +2H2O=5
+2H2O=5 +2Mn2++4H+。
+2Mn2++4H+。Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。

①通入空气前应进行的实验操作是
②当观察到实验的现象为
③实验过程中需测量并记录的数据是
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。

①工厂区、交通枢纽SO2含量明显高于其他地区的原因是
②请向当地有关部门提出一条减少工厂区SO2排放的建议:
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
| 天气情况 | 平均风速(m·s−1) | 空气中SO2的平均含量(mg·L−1) |
| 雨前 | 2.0 | 0.03 |
| 雨后 | 2.2 | 0.01 |
| 晴 | 23 | 0.015 |
| 晴 | 0.9 | 0.03 |
①
②
您最近一年使用:0次
2018-08-09更新
|
317次组卷
|
7卷引用:2018年高一化学(人教版)必修1综合题型练习卷:非金属及其化合物
2018年高一化学(人教版)必修1综合题型练习卷:非金属及其化合物(已下线)2018年12月3日——《每日一题》高一人教必修1-二氧化硫和二氧化氮对大气的污染及其防治(已下线)2019年12月2日 《每日一题》人教版(必修1)——二氧化硫和二氧化氮对大气的污染及其防治(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.3.1 硫循环-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
4 . 亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液。
(1)要证明Na2SO3具有还原性,应选用的试剂有_________________________________ ,看到的现象是______________ ,反应的离子方程式为________________________________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_________________________________ ,看到的现象是______________________ ,反应的离子方程式为__________________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
您最近一年使用:0次
名校
解题方法
5 . 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是
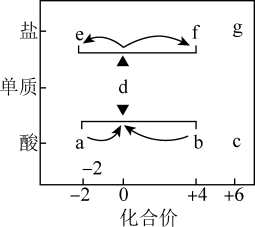
| A.b既具有氧化性又具有还原性 |
| B.硫酸型酸雨的形成过程涉及b到c的转化 |
| C.a溶液与b溶液反应过程中有淡黄色沉淀生成 |
| D.d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:2 |
您最近一年使用:0次
2022-04-23更新
|
1474次组卷
|
8卷引用:专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)
6 . “环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___________ 污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以NH 和NH3·H2O形式存在,为达到变废为宝回收利用的目的,某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的,某团队设计处理流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现NH →NO
→NO →NO
→NO 的转化,在碱性条件下NH
的转化,在碱性条件下NH 被氧气氧化成NO
被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为___________ 。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO →N2的转化,将lmol NO
→N2的转化,将lmol NO 完全转化为N2,转移的电子数为
完全转化为N2,转移的电子数为___________ 。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为___________ 。某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___________ 吨(假设生产过程中96%SO2转化为SO3)。
(1)排放到大气中的氮的氧化物,会造成
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以NH
 和NH3·H2O形式存在,为达到变废为宝回收利用的目的,某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的,某团队设计处理流程如下:
过程Ⅱ为硝化过程,在微生物的作用下实现NH
 →NO
→NO →NO
→NO 的转化,在碱性条件下NH
的转化,在碱性条件下NH 被氧气氧化成NO
被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO
 →N2的转化,将lmol NO
→N2的转化,将lmol NO 完全转化为N2,转移的电子数为
完全转化为N2,转移的电子数为(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为
您最近一年使用:0次
名校
7 . 下列关于硫及其化合物叙述正确的是
| A.空气中排放过量SO2会形成酸雨,且酸雨的pH会随时间增长而增大 |
B.浓硫酸与S反应为2H2SO4(浓)+S 3SO2↑+2H2O,在此反应中浓硫酸既表现了强氧化性又表现了酸性 3SO2↑+2H2O,在此反应中浓硫酸既表现了强氧化性又表现了酸性 |
| C.将浓硫酸加入滴有几滴水的蔗糖中,蔗糖逐渐变黑形成“黑面包”,产生有刺激性气体,体现浓硫酸的脱水性和强氧化性 |
| D.把足量的铜粉投入只含2molH2SO4的浓硫酸中,加热得到的气体体积在标准状况下为22.4L |
您最近一年使用:0次
2024-02-13更新
|
762次组卷
|
5卷引用:5.1.2硫酸课后作业基础篇
(已下线)5.1.2硫酸课后作业基础篇(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)(已下线)重难点01 浓硫酸、浓硝酸的性质与反应计算-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)江苏省盐城市盐城一中、射阳中学、滨海中学2023-2024学年高一上学期期末联考化学试卷新疆维霍尔果斯市苏港中学2023-2024学年高一下学期4月月考化学试题
名校
8 . 下列说法正确的是
| A.刚落下的酸雨随时间增加酸性逐渐增强,是由于雨水中溶解了CO2 |
| B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| C.氧化性:HClO>稀H2SO4,故非金属性:Cl>S |
| D.将饱和FeCl3溶液煮沸至红褐色,可制得氢氧化铁胶体 |
您最近一年使用:0次
2019-04-02更新
|
594次组卷
|
4卷引用:【区级联考】天津部分区联考2019届高三上学期一模考试化学试题
【区级联考】天津部分区联考2019届高三上学期一模考试化学试题(已下线)专题2.1 物质的组成、性质及分类(练)-《2020年高考一轮复习讲练测》天津市南开中学2020届高三第四次月考(线上考试) 化学试题(已下线)第4章 非金属及其化合物 单元测试(测)——2020年高考化学一轮复习讲练测
名校
9 . 化学与人类生产、生活密切相关,下列说法正确的是
| A.做衣服的棉和麻均与淀粉互为同分异构体 |
| B.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D.用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
您最近一年使用:0次
2016-12-09更新
|
502次组卷
|
6卷引用:2016届宁夏银川一中高三一模化学试卷
11-12高三上·江苏无锡·阶段练习
10 . 近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:_____________________________ 。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:_________________ 。
③写出步骤(Ⅲ)反应的离子方程式:______________________ 。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42—而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42—的转化率。
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是________ 。(填写字母)
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42—的转化率,已知气体流速,还需测定的数据有______ 、____ 。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:
③写出步骤(Ⅲ)反应的离子方程式:
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42—而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42—的转化率。

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42—的转化率,已知气体流速,还需测定的数据有
您最近一年使用:0次



