1 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)可用于制作计算机芯片和太阳能电池的是_______ (填化学式,下同),光导纤维的主要成分是_______ 。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为_______ 。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:_______ 。
(4)高纯度单晶硅可以按下列方法制备:SiO2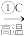 Si(粗)
Si(粗)  SiiHCl3
SiiHCl3 Si(纯)。写出步骤①的化学方程式:
Si(纯)。写出步骤①的化学方程式:_____ 。该反应中C作____ 剂,此方程式能否说明非金属性:C>Si____ 。若要证明C和Si的非金属性强弱,请设计实验并预测实验现象____ 。
(1)可用于制作计算机芯片和太阳能电池的是
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(4)高纯度单晶硅可以按下列方法制备:SiO2
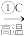 Si(粗)
Si(粗)  SiiHCl3
SiiHCl3 Si(纯)。写出步骤①的化学方程式:
Si(纯)。写出步骤①的化学方程式:
您最近半年使用:0次
2 . (1)SiO2在自然界中广泛存在,它是制备现代通讯材料___ (写该材料名称)的主要原料;以SiO2为原料,在工业上制备单质粗硅的化学方程式为___ ;在常温下,SiO2可与一种酸发生反应,该反应的化学方程式为___ 。该反应的重要应用是__ 。
(2)在一定体积的18mol/L的浓硫酸加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积___ (填“大于”“小于”或“等于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式__ 。
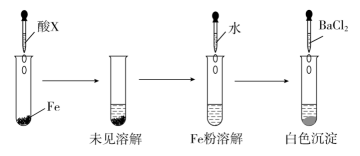
(3)根据下图操作及现象推断酸X为__ 。
(2)在一定体积的18mol/L的浓硫酸加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积
(3)根据下图操作及现象推断酸X为

您最近半年使用:0次
2021-06-23更新
|
152次组卷
|
2卷引用:黑龙江省哈尔滨市延寿县第二中学2020-2021学年高一5月月考化学试题
3 . 下列说法不正确的是 ( )
| A.氯气是一种重要的化工原料,广泛应用于自来水的消毒和农药的生产等方面 |
| B.化肥的生产、金属矿石的处理、金属材料的表面清洗等都可能用到硫酸 |
| C.利用光线在硅晶体内的全反射现象,可以制备光导纤维 |
| D.铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 |
您最近半年使用:0次
4 . 硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式______________ .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式____________ ;H2还原SiHCl3过程中若混O2,可能引起的后果是____________ .
(2)下列有关硅材料的说法正确的是_________ (填字母)。
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释____________________ 。
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式
(2)下列有关硅材料的说法正确的是
| A.高纯度的硅,可用于生产光电池,将光能直接转换为电能 |
| B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维 |
| D.普通玻璃是由纯碱.石灰石和石英砂制成的 |
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释
您最近半年使用:0次
5 . 非金属材料及其化合物是无机非金属材料的主要成分,硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
I.
(1)计算机芯片和太阳能电池的主要成分是___________ (填化学式,下同);光导纤维的主要成分是___________ ;工艺师常用氢氟酸来雕刻玻璃,其原理为___________ (填化学方程式)。
Ⅱ.高纯度单晶硅的制备方法:

某同学从资料中查知:SiCl4的熔点为-70℃,沸点为57.6℃,在潮湿的空气中与水发生反应而变质。该同学设计了如图装置制取纯硅(装置中的热源及夹持装置均已略去)。
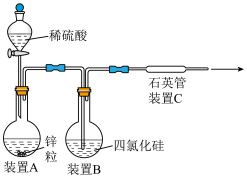
(2)已知:步骤①生成的另一产物为CO,写出步骤①中反应的化学方程式:___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
(4)已知:SiCl4在潮湿的空气中能与水发生反应生成氯化氢。为防止空气污染,含有SiCl4的尾气可通入盛有___________ (填试剂名称)的烧杯中。
(5)同学甲认为用该装置进行实验,可能会导致实验失败,为保证制备纯硅实验的成功,你认为该装置应进行的改进措施是___________ 。
I.
(1)计算机芯片和太阳能电池的主要成分是
Ⅱ.高纯度单晶硅的制备方法:

某同学从资料中查知:SiCl4的熔点为-70℃,沸点为57.6℃,在潮湿的空气中与水发生反应而变质。该同学设计了如图装置制取纯硅(装置中的热源及夹持装置均已略去)。

(2)已知:步骤①生成的另一产物为CO,写出步骤①中反应的化学方程式:
(3)装置A中发生反应的离子方程式为
(4)已知:SiCl4在潮湿的空气中能与水发生反应生成氯化氢。为防止空气污染,含有SiCl4的尾气可通入盛有
(5)同学甲认为用该装置进行实验,可能会导致实验失败,为保证制备纯硅实验的成功,你认为该装置应进行的改进措施是
您最近半年使用:0次
名校
解题方法
6 . 非金属虽然种类虽然不多,但是与人类的关系密切,回忆几种常见非金属一硅、氯、硫、氮及其化合物的重要性质,回答下列问题:
(1)在无机非金属材料中,硅一直扮演着主要的角色,有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥人工制造的分子筛⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片。所用材料为SiO2或要用到SiO2的是_______ 。
A.④⑤⑦⑧⑨ B.④⑤⑦⑨ C.④⑤⑦⑨ D.①④⑤⑦⑨⑩
(2)1774年,瑞典化学家舍勒在研究软锰矿的过程中发现了氯气。现为了进行有关氯气的性质实验,需要4瓶容积为50mL的氯气(室温下,氯气的密度约为2.9g/L),则用舍勒的方法制取3瓶氯气理论上需要MnO2固体的质量是_____ g(保留到小数点后一位,浓盐酸过量,可以补充);实际称量的MnO2固体的质量必须多于理论量,其原因是_____ ,由于氯气有毒,拆除装置时需要对反应装置内氯气进行处理,以下最理想的吸收剂是_____
A.NaOH溶液 B.浓氨水 C.澄清石灰水 D.水
(3)硫酸和硝酸都是重要的化工原料,在工业上可以用于制化肥、农药、炸药、盐类等。
①现以洗净的废铜屑和浓硝酸为原料,制取硝酸铜,请设计一个既能节约原料又能防止污染环境的方法(用化学方程式表示)____________ 。
②下列现象中硫酸所表现出的性质中含有强氧化性的是________ 。
A.把锌粒放入稀硫酸中时,有气体放出
B.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
C.把浓硫酸倒入润湿的蔗糖中,蔗糖变黑,且有刺激性气味气体生成
D.把木炭放入热的浓硫酸中时,有气体放出
E.在常温下可以用铁、铝制容器盛装冷的浓硫酸
(1)在无机非金属材料中,硅一直扮演着主要的角色,有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥人工制造的分子筛⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片。所用材料为SiO2或要用到SiO2的是
A.④⑤⑦⑧⑨ B.④⑤⑦⑨ C.④⑤⑦⑨ D.①④⑤⑦⑨⑩
(2)1774年,瑞典化学家舍勒在研究软锰矿的过程中发现了氯气。现为了进行有关氯气的性质实验,需要4瓶容积为50mL的氯气(室温下,氯气的密度约为2.9g/L),则用舍勒的方法制取3瓶氯气理论上需要MnO2固体的质量是
A.NaOH溶液 B.浓氨水 C.澄清石灰水 D.水
(3)硫酸和硝酸都是重要的化工原料,在工业上可以用于制化肥、农药、炸药、盐类等。
①现以洗净的废铜屑和浓硝酸为原料,制取硝酸铜,请设计一个既能节约原料又能防止污染环境的方法(用化学方程式表示)
②下列现象中硫酸所表现出的性质中含有强氧化性的是
A.把锌粒放入稀硫酸中时,有气体放出
B.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
C.把浓硫酸倒入润湿的蔗糖中,蔗糖变黑,且有刺激性气味气体生成
D.把木炭放入热的浓硫酸中时,有气体放出
E.在常温下可以用铁、铝制容器盛装冷的浓硫酸
您最近半年使用:0次
7 . 三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):

C反应温度控制在60~65℃,不能过高或过低的原因是___________ 。分离提纯获得POCl3的实验方法是___________ 。
已知:PCl3、POCl3的部分性质如下:
| 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

C反应温度控制在60~65℃,不能过高或过低的原因是
您最近半年使用:0次
8 . 某化学实验小组同学利用以下实验装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为_________ 。
(2)用装置 B 收集氨气时,应选择氨气的进气口是_________ (选填“a”或“b”),并说明选择的理由是_________ 。
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_____ ,请用方程式表示:_______________________________ ;氨气催化氧化可用于制硝酸,请写出氨气催化氧化的化学方程式 _______________________________ 。
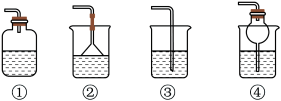
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_______ (填序号)。
(5)SiO2在自然界中广泛存在,它是制备现代通讯材料________ (写该材料名称)的主要原料;以 SiO2为原料, 在工业上制备单质硅的化学方程式为________

(1)实验室制备氨气的化学方程式为
(2)用装置 B 收集氨气时,应选择氨气的进气口是
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是

(5)SiO2在自然界中广泛存在,它是制备现代通讯材料
您最近半年使用:0次
9 . 材料的不断发展可以促进社会进步。 完成下列填空:
(1) “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是____________________ 。(任写一点)
(2)光导纤维简称“光纤”,是一种由玻璃制成、能传输光线、结构特殊的玻璃纤维。现在家中的电话线和网线大都采用光纤线。光纤的主要成分是二氧化硅,二氧化硅的晶体类型是____________________ 。(单选)
a.金属晶体 b.离子晶体 c.原子晶体 d.分子晶体
(3)随着我国经济的快速发展,对电池新材料需求的不断增加,再加上手机、笔记本电脑、数码相机、摄像机、汽车等产品对新型、高效、环保电池材料的强劲需求,我国电池新材料市场将不断扩大。而铜锌原电池是一种最基本的将化学能转变为电能的装置,其中铜作________ 极,锌作_________ 极。
(4)塑料制品作为一种新型材料,具有质轻、防水、耐用、生产技术成熟、成本低的优点,在全世界被广泛应用且呈逐年增长趋势。乙烯通过加聚反应可以制成聚乙烯塑料,请写出聚乙烯的结构简式____________________ 。
(1) “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是
(2)光导纤维简称“光纤”,是一种由玻璃制成、能传输光线、结构特殊的玻璃纤维。现在家中的电话线和网线大都采用光纤线。光纤的主要成分是二氧化硅,二氧化硅的晶体类型是
a.金属晶体 b.离子晶体 c.原子晶体 d.分子晶体
(3)随着我国经济的快速发展,对电池新材料需求的不断增加,再加上手机、笔记本电脑、数码相机、摄像机、汽车等产品对新型、高效、环保电池材料的强劲需求,我国电池新材料市场将不断扩大。而铜锌原电池是一种最基本的将化学能转变为电能的装置,其中铜作
(4)塑料制品作为一种新型材料,具有质轻、防水、耐用、生产技术成熟、成本低的优点,在全世界被广泛应用且呈逐年增长趋势。乙烯通过加聚反应可以制成聚乙烯塑料,请写出聚乙烯的结构简式
您最近半年使用:0次
10 . 下列说法正确的是
| A.在一定条件下,某可逆反应的ΔH =+100 kJ·mol-1,则该反应正反应活化能比逆反应活化能大100 kJ·mol-1 |
B.在100 ℃、101 kPa条件下,液态水的汽化热为40.69 kJ·mol-1,则H2O(g)  H2O(l) ΔH= +40.69 kJ·mol -1 H2O(l) ΔH= +40.69 kJ·mol -1 |
| C.二氧化硅是光导纤维的主要成分,利用了它的半导体性质 |
D.实验室可利用如图装置制备氨气 |
您最近半年使用:0次



