名校
解题方法
1 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。二氧化硅又称硅石,是制备硅及其化合物的重要原料,部分转化过程如图所示。回答下面问题:_______ (填字母)。
A.碳元素和硅元素都位于周期表的IVA族,非金属性较强的是碳元素
B.自然界中存在天然游离的硅单质
C.玻璃、水泥、陶瓷都是传统的硅酸盐产品
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.硅元素在金属与非金属的分界线处,因此具弱导电性,一般可用作半导体材料
(2)光导纤维是一种良好的通讯材料,其成分是_______ (填化学式,下同),高纯硅是制造半导体芯片的基础原材料,由SiO2制备高纯度硅的工业流程如上图所示,可以循环使用的物质为_______ 和_______ ,写出第①步的化学方程式_______ 。
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学反应方程式为_______ 。
(4)氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。
①根据氮和硅的原子结构示意图、元素周期律的知识,写出氮化硅的化学式_______ 。
②根据以上描述,推测氮化硅可能有哪些用途:_______ (填字母)。
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具

A.碳元素和硅元素都位于周期表的IVA族,非金属性较强的是碳元素
B.自然界中存在天然游离的硅单质
C.玻璃、水泥、陶瓷都是传统的硅酸盐产品
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.硅元素在金属与非金属的分界线处,因此具弱导电性,一般可用作半导体材料
(2)光导纤维是一种良好的通讯材料,其成分是
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学反应方程式为
(4)氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。
①根据氮和硅的原子结构示意图、元素周期律的知识,写出氮化硅的化学式
②根据以上描述,推测氮化硅可能有哪些用途:
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
您最近一年使用:0次
名校
解题方法
2 . 高纯硅用于制作光伏电池,如图是一种生产高纯硅的工艺流程图:__________ 。
(2)Si在元素周期表中的位置为__________ 。硅属于碳族元素,二氧化碳的结构式为_______ ,写出石英砂的主要成分________ ,它是制玻璃的原料之一,工业上通常用HF的水溶液溶蚀玻璃制磨砂玻璃,该过程的化学方程式为________________ 。
(3)电弧炉中生成粗硅,反应的化学方程式为______________ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为_________ 。
(4)还原炉中用SiHCl3与过量H2在1100℃下反应,试写出反应的化学方程式____________ 。

(2)Si在元素周期表中的位置为
(3)电弧炉中生成粗硅,反应的化学方程式为
(4)还原炉中用SiHCl3与过量H2在1100℃下反应,试写出反应的化学方程式
您最近一年使用:0次
3 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
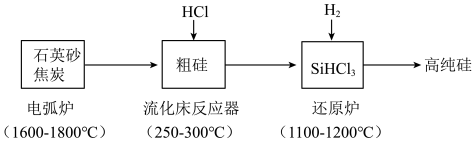
(1)Si的原子结构示意图为_______ 。
(2)写出电弧炉发生的反应的化学方程式为_______ 。当有1mol单质碳参与反应时,该反应转移的电子数是_______ (用NA表示)。
(3)整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl气体和一种气体单质,写出该反应的化学反应方程式_______ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为_______ 。
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式_______ 。
(6)关于硅及其相关化合物的叙述正确的是_______ 。
A.自然界中存在天然游离的硅单质
B.已知C与Si在同一主族,由于CO2+H2O=H2CO3,用类比法得知SiO2+H2O=H2SiO3
C.Na[AlSi3O8]用氧化物形式表示为Na2O•Al2O3•6SiO2
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
F.玻璃、水泥、陶瓷都是传统的硅酸盐产品

(1)Si的原子结构示意图为
(2)写出电弧炉发生的反应的化学方程式为
(3)整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl气体和一种气体单质,写出该反应的化学反应方程式
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式
(6)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与Si在同一主族,由于CO2+H2O=H2CO3,用类比法得知SiO2+H2O=H2SiO3
C.Na[AlSi3O8]用氧化物形式表示为Na2O•Al2O3•6SiO2
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
F.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
名校
解题方法
4 . 孔雀石主要成分是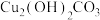 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
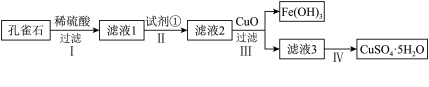
有关物质沉淀的pH数据如下:
(1)步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是___________ (填化学式),该物质进一步提纯后可用于制造___________ 。提高步骤Ⅰ反应速率的措施是___________ (写一条即可)。
(2)步骤Ⅱ中试剂①应选用试剂___________ (填序号)。
a. b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水
相关反应的离子方程式为___________ 。
(3)步骤Ⅲ加入CuO调节溶液pH至___________ (填写范围),目的是___________ 。
(4)由滤液3获得硫酸铜晶体需经过___________ 、___________ 、过滤、洗涤、干燥。
(5)常温下 的
的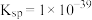 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
___________ 。
(6)用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的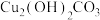 可以生成1.5mol金属铜,则该反应的化学方程式为
可以生成1.5mol金属铜,则该反应的化学方程式为___________ 。
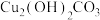 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
| 物质 | pH(开始沉淀) | pH(完全沉淀) |
 | 1.9 | 3.2 |
 | 7.0 | 9.0 |
 | 4.7 | 6.7 |
(1)步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是
(2)步骤Ⅱ中试剂①应选用试剂
a.
 b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水相关反应的离子方程式为
(3)步骤Ⅲ加入CuO调节溶液pH至
(4)由滤液3获得硫酸铜晶体需经过
(5)常温下
 的
的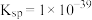 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
(6)用
 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的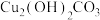 可以生成1.5mol金属铜,则该反应的化学方程式为
可以生成1.5mol金属铜,则该反应的化学方程式为
您最近一年使用:0次
5 . 为探究固体X(仅含两种常见短周期元素)的组成和性质,设计并完成如下实验:

已知:气体A是一种纯净物,标准状况下 的A质量为
的A质量为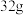 ;固体B是光导纤维的主要成分。请回答:
;固体B是光导纤维的主要成分。请回答:
(1)气体A的摩尔质量为_______ 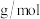 ;A分子的电子式
;A分子的电子式_______ 。
(2)B的化学式_______ ;D的化学式_______ 。
(3)固体X与稀硫酸反应的离子方程式是_______ 。
(4)已知 与气体A在一定条件下反应后可得到一种耐高温陶瓷材料(仅含两种元素,摩尔质量为
与气体A在一定条件下反应后可得到一种耐高温陶瓷材料(仅含两种元素,摩尔质量为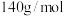 )和
)和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。

已知:气体A是一种纯净物,标准状况下
 的A质量为
的A质量为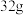 ;固体B是光导纤维的主要成分。请回答:
;固体B是光导纤维的主要成分。请回答:(1)气体A的摩尔质量为
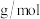 ;A分子的电子式
;A分子的电子式(2)B的化学式
(3)固体X与稀硫酸反应的离子方程式是
(4)已知
 与气体A在一定条件下反应后可得到一种耐高温陶瓷材料(仅含两种元素,摩尔质量为
与气体A在一定条件下反应后可得到一种耐高温陶瓷材料(仅含两种元素,摩尔质量为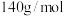 )和
)和 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次
2021高三·全国·专题练习
6 . 青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x],可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右一次烧成的釉可形成精美的青花瓷。
(1)下列说法正确的是___ (填选项字母)。
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。

①洗涤石英砂的目的是___ 。
②在以上流程中,要将洗净的石英砂研磨成粉末,目的是___ 。
③工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1。下列说法正确的是___ (填选项字母)。
A.SiC性质稳定,能用于制造抗高温水泥
B.制造粗硅时的反应为2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
C.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
D.纯净的SiO2只能用于制造光导纤维
(1)下列说法正确的是
| A.高岭土分子中x=2 |
| B.钾长石能完全溶解在盐酸中形成澄清的溶液 |
| C.烧制青花瓷过程中发生了复杂的物理变化和化学变化 |
| D.青花瓷、玻璃、水泥都属于硅酸盐产品 |

①洗涤石英砂的目的是
②在以上流程中,要将洗净的石英砂研磨成粉末,目的是
③工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1。下列说法正确的是
A.SiC性质稳定,能用于制造抗高温水泥
B.制造粗硅时的反应为2SiO2+5C
 Si+SiC+4CO↑
Si+SiC+4CO↑C.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
D.纯净的SiO2只能用于制造光导纤维
您最近一年使用:0次
7 . 硅是带来人类文明的重要元素之一,工业上可用石英砂制备。
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)硅和锗( )属于同主族元素。下列预测合理的是
)属于同主族元素。下列预测合理的是___________ (填序号)。
a. 与
与 化合易于
化合易于 b. 常温下
b. 常温下 是固体
是固体
c.酸性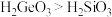 d.
d. 和
和 都可做半导体材料
都可做半导体材料
(3)高纯 可用于制造
可用于制造___________ 。
(4)下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。
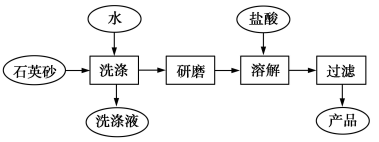
①洗涤石英砂的目的是___________ 。
②将洗净的石英砂研磨成粉末,目的是___________ 。
③在以上流程中,能否将盐酸改为 溶液,请说明理由
溶液,请说明理由___________ 。
(5)氮化硅( )是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气流中通过以下反应制备:
)是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气流中通过以下反应制备:
①氮化硅中氮元素的化合价___________ 。
②若生成 (标准状况),则生成氮化硅的质量是
(标准状况),则生成氮化硅的质量是___________  (保留一位小数)。
(保留一位小数)。
(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)硅和锗(
 )属于同主族元素。下列预测合理的是
)属于同主族元素。下列预测合理的是a.
 与
与 化合易于
化合易于 b. 常温下
b. 常温下 是固体
是固体c.酸性
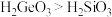 d.
d. 和
和 都可做半导体材料
都可做半导体材料(3)高纯
 可用于制造
可用于制造(4)下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。

①洗涤石英砂的目的是
②将洗净的石英砂研磨成粉末,目的是
③在以上流程中,能否将盐酸改为
 溶液,请说明理由
溶液,请说明理由(5)氮化硅(
 )是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气流中通过以下反应制备:
)是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气流中通过以下反应制备:
①氮化硅中氮元素的化合价
②若生成
 (标准状况),则生成氮化硅的质量是
(标准状况),则生成氮化硅的质量是 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次
8 . 几种主族元素在元素周期表中的位置如下表所示:
回答下列问题:
(1)硅元素在周期表中的位置是___________ ,其氧化物的用途___________ (任写一种)。
(2)①②④三种元素的简单离子半径由大到小的顺序是___________ (填离子符号)。
(3)②③⑤三种元素最高价氧化物的水化物的碱性最强的是___________ (填化学式),该物质与元素③的最高价氧化物的水化物反应的离子方程式为___________ 。
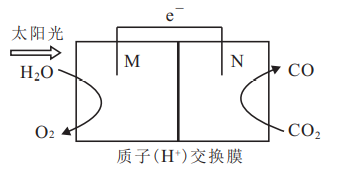
(4)科学家利用下图所示电池装置可以将 转化为气体燃料
转化为气体燃料 。该装置工作时,N电极为
。该装置工作时,N电极为___________ (填“正极”或“负极”),电子流向为___________ (填“M→N”或“N→M”)。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅢA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | |||||
| 4 | ⑤ |
(1)硅元素在周期表中的位置是
(2)①②④三种元素的简单离子半径由大到小的顺序是
(3)②③⑤三种元素最高价氧化物的水化物的碱性最强的是
(4)科学家利用下图所示电池装置可以将
 转化为气体燃料
转化为气体燃料 。该装置工作时,N电极为
。该装置工作时,N电极为
您最近一年使用:0次
名校
解题方法
9 . 已知A、B、C、D、E、F、G、H可以发生如图所示转化,反应中部分生成物已略去。其中,A、G为非金属单质,且常湿下呈固态,形成G单质的元素在地壳中含量居第二位,B、C、H在通常情况下为气体,化合物C是一种能形成酸雨的大气污染物。

请回答下列问题:
(1)写出E的两种用途:______ 、______ 。
(2)反应②的离子方程式为______ 。
(3)反应③的化学方程式是______ 。
(4)反应④的离子方程式是______ 。
(5)写出一个由A生成H的置换反应的化学方程式:______ 。

请回答下列问题:
(1)写出E的两种用途:
(2)反应②的离子方程式为
(3)反应③的化学方程式是
(4)反应④的离子方程式是
(5)写出一个由A生成H的置换反应的化学方程式:
您最近一年使用:0次
2021-02-16更新
|
688次组卷
|
3卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第三节 无机非金属材料
(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第三节 无机非金属材料(已下线)第09讲 硅的化合物 新型无机非金属材料(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)甘肃省靖远县第一中学2021-2022学年高一下学期4月月考化学试题
10 . 某化学实验小组同学利用以下实验装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为_________ 。
(2)用装置 B 收集氨气时,应选择氨气的进气口是_________ (选填“a”或“b”),并说明选择的理由是_________ 。
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_____ ,请用方程式表示:_______________________________ ;氨气催化氧化可用于制硝酸,请写出氨气催化氧化的化学方程式 _______________________________ 。
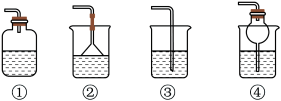
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_______ (填序号)。
(5)SiO2在自然界中广泛存在,它是制备现代通讯材料________ (写该材料名称)的主要原料;以 SiO2为原料, 在工业上制备单质硅的化学方程式为________

(1)实验室制备氨气的化学方程式为
(2)用装置 B 收集氨气时,应选择氨气的进气口是
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是

(5)SiO2在自然界中广泛存在,它是制备现代通讯材料
您最近一年使用:0次



