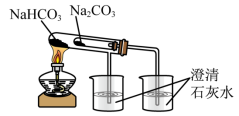
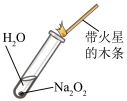
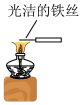
1 . 根据金属钠与水(滴有酚酞)反应的现象,下列有关说法错误的是
| A.钠熔化成闪亮的小球,说明钠的熔点低且反应放热 |
| B.反应后溶液的颜色逐渐变红,说明反应生成了碱 |
| C.该反应中每1mol的Na得到1mol的电子 |
| D.当火灾现场存放有大量金属钠时不能用水来灭火 |
您最近一年使用:0次
解题方法
2 . 下列实验装置不能达到实验目的的是
|
|
A.比较 、 、 的热稳定性 的热稳定性 | B.检验 与 与 反应有 反应有 生成 生成 |
|
|
| C.观察纯碱的焰色试验 | D.验证Na和水反应是否为放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下列离子方程式中,错误的是
| A.钠投入到中:2Na+2H2O=2Na++2OH-+H2↑ |
B.过量的二氧化硫与氢氧化钠溶液反应:2OH-+SO2=SO +H2O +H2O |
| C.氯化铁溶液与铁反应:2Fe3++Fe=3Fe2+ |
| D.FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+ |
您最近一年使用:0次
4 . 下列指定反应的离子方程式正确的是
| A.稀硫酸滴到铜片上:Cu+2H+=Cu2++H2↑ |
| B.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
C.向AlCl3溶液中加入过量氨水:Al3++4OH﹣= +2H2O +2H2O |
D.醋酸溶解鸡蛋壳:2H++CO =CO2↑+H2O =CO2↑+H2O |
您最近一年使用:0次
5 . 下列实验装置(部分夹持装置略)或现象正确的是
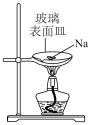 |
| 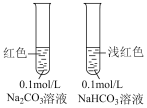 |  |
| A.制备氧化钠 | B.钠与水反应 | C.滴入酚酞溶液 | D.检验 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
名校
解题方法
7 . 下列表示对应化学反应的离子方程式正确的是
| A.Cl2通入氢氧化钠溶液:Cl2 + 2OH- = Cl- + ClO- + H2O |
| B.Na与水的反应离子方程式:2Na + 2H+=2Na+ + H2↑ |
| C.Na2O2与水反应: Na2O2 + 2H2O=2Na+ + 2OH-+ O2↑ |
| D.向CaCl2溶液中通入CO2:Ca2+ + H2O + CO2 = CaCO3 + 2H+ |
您最近一年使用:0次
解题方法
8 . 某小组想通过实验探究 Na、Mg、Al 三种金属元素性质的递变规律。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式___________ 。
(2)上述反应中,作还原剂的是___________ 。
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为___________ L。
(4)溶液中,使酚酞试液变红的微粒是___________ 。
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是___________ 。
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是___________ 。
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
(8)综上实验可知,NaOH、Mg(OH)2、Al(OH)3的碱性由强到弱的顺序是___________ 。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式
(2)上述反应中,作还原剂的是
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为
(4)溶液中,使酚酞试液变红的微粒是
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
| 现象 | 结论 | |
| ④ | 出现白色沉淀 | Al(OH)3的碱性比NaOH弱 |
| 沉淀全部溶解 | ||
| ⑤ | 出现白色沉淀 | |
| 沉淀不溶解 | Mg(OH)2无酸性 |
您最近一年使用:0次
名校
9 . 下列关于钠及其化合物的说法正确的是
| A.钠钾合金在室温下呈液态,可用作核反应堆的传热介质 |
B.将金属钠放入 溶液中,可观察到大量红色的铜析出 溶液中,可观察到大量红色的铜析出 |
| C.配制一定物质的量浓度的氢氧化钠溶液时,将氢氧化钠固体溶解后立即转移至容量瓶中定容 |
D. 与 与 都能和水反应生成碱,故两者均为碱性氧化物 都能和水反应生成碱,故两者均为碱性氧化物 |
您最近一年使用:0次
名校
10 . 下列离子方程式错误 的是
A.碳酸氢钠溶液与氢氧化钠混合反应: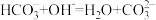 |
| B.氯气与水反应:Cl2 + H2O = 2H+ + Cl-+ ClO- |
| C.金属钠投入足量盐酸中反应:2Na + 2H+ = 2Na+ + H2↑ |
D.碳酸氢钙溶液与少量澄清石灰水混合反应:Ca2+ + HCO + OH- = CaCO3↓ + H2O + OH- = CaCO3↓ + H2O |
您最近一年使用:0次
2024-02-11更新
|
109次组卷
|
2卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题