名校
解题方法
1 . 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有 或
或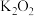 颗粒的装置,它的用途是产生氧气。下列关于
颗粒的装置,它的用途是产生氧气。下列关于 或
或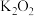 的说法正确的个数是
的说法正确的个数是
① 中阴、阳离子的个数比是1:1;
中阴、阳离子的个数比是1:1;
②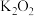 分别与水及
分别与水及 反应产生等量氧气时,需水和
反应产生等量氧气时,需水和 的质量相等;
的质量相等;
③ 分别与水及
分别与水及 反应产生等量氧气时,转移电子的物质的量相等;
反应产生等量氧气时,转移电子的物质的量相等;
④ 与
与 反应生成
反应生成 和
和 ;
;
⑤ 能与酸反应生成盐和水,所以
能与酸反应生成盐和水,所以 是碱性氧化物;
是碱性氧化物;
⑥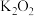 与水反应,
与水反应,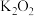 既是氧化剂,又是还原剂;
既是氧化剂,又是还原剂;
⑦ 投入到紫色石蕊溶液中,溶液先变蓝,后褪色。
投入到紫色石蕊溶液中,溶液先变蓝,后褪色。
 或
或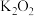 颗粒的装置,它的用途是产生氧气。下列关于
颗粒的装置,它的用途是产生氧气。下列关于 或
或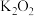 的说法正确的个数是
的说法正确的个数是 ①
 中阴、阳离子的个数比是1:1;
中阴、阳离子的个数比是1:1;②
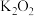 分别与水及
分别与水及 反应产生等量氧气时,需水和
反应产生等量氧气时,需水和 的质量相等;
的质量相等;③
 分别与水及
分别与水及 反应产生等量氧气时,转移电子的物质的量相等;
反应产生等量氧气时,转移电子的物质的量相等;④
 与
与 反应生成
反应生成 和
和 ;
;⑤
 能与酸反应生成盐和水,所以
能与酸反应生成盐和水,所以 是碱性氧化物;
是碱性氧化物;⑥
 与水反应,
与水反应, 既是氧化剂,又是还原剂;
既是氧化剂,又是还原剂;⑦
 投入到紫色石蕊溶液中,溶液先变蓝,后褪色。
投入到紫色石蕊溶液中,溶液先变蓝,后褪色。| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
2023-01-02更新
|
226次组卷
|
2卷引用:河南省郑州市中牟县第一高级中学2022-2023学年高一上学期第二次月考化学试题
解题方法
2 . W、X、Y、Z为原子序数依次增大的短周期主族元素。已知:W、X、Z三种元素在元素周期表中的相对位置如图所示,且常温下W和Z常见单质的状态不同,Y的原子半径在短周期主族元素中是最大的。下列说法正确的是
| W | X |
| Z |
| A.W、X、Z三种元素中电负性最大的是Z |
B.四种元素的简单离子的半径由大到小的顺序为 |
C. 可与 可与 反应生成 反应生成 和 和 |
| D.W和Z的最高价氧化物对应的水化物均为强酸 |
您最近一年使用:0次
名校
解题方法
3 . 过氧化钠( )是中学常见物质。已知:
)是中学常见物质。已知: 与
与 均可与
均可与 反应。有人提出
反应。有人提出 、
、 与
与 的反应原理相同;但也有人提出,
的反应原理相同;但也有人提出, 具有较强还原性,与
具有较强还原性,与 发生反应氧化还原反应,生成硫酸盐。
发生反应氧化还原反应,生成硫酸盐。
(1)下列溶液中,不能用于鉴别 和
和 气体的是
气体的是_______ (填字母编号)。
A.酸化的 溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D.
溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D. 溶液 E.品红溶液
溶液 E.品红溶液
(2)实验一:向一定量的 固体中通入足量的
固体中通入足量的 ,取反应后的固体进行实验探究,以证明过氧化物与
,取反应后的固体进行实验探究,以证明过氧化物与 反应的特点,提出假设:
反应的特点,提出假设:
假设1:反应后固体中只有_______ ,证明 未氧化;
未氧化;
假设2:反应后固体中只有_______ ,证明 完全被氧化;
完全被氧化;
假设3:反应后固体中同时含有上述两种物质,证明 部分被氧化。
部分被氧化。
(3)实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
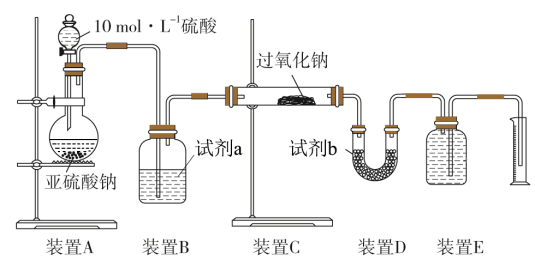
①试剂a可以选用_______ ,试剂b可以选用_______ ;
②若 完全被氧化,写出反应的化学方程式
完全被氧化,写出反应的化学方程式_______ 。
③若 未被氧化,实验测得装置C中
未被氧化,实验测得装置C中 质量增加了
质量增加了 g:装置E中收集气体为VL(标准状况下),写出反应的化学方程式:
g:装置E中收集气体为VL(标准状况下),写出反应的化学方程式:_______ ,用上述有关测量数据判断V与m的关系式:
_______ (用含m的代数式表示,可以不化简)。
 )是中学常见物质。已知:
)是中学常见物质。已知: 与
与 均可与
均可与 反应。有人提出
反应。有人提出 、
、 与
与 的反应原理相同;但也有人提出,
的反应原理相同;但也有人提出, 具有较强还原性,与
具有较强还原性,与 发生反应氧化还原反应,生成硫酸盐。
发生反应氧化还原反应,生成硫酸盐。(1)下列溶液中,不能用于鉴别
 和
和 气体的是
气体的是A.酸化的
 溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D.
溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D. 溶液 E.品红溶液
溶液 E.品红溶液(2)实验一:向一定量的
 固体中通入足量的
固体中通入足量的 ,取反应后的固体进行实验探究,以证明过氧化物与
,取反应后的固体进行实验探究,以证明过氧化物与 反应的特点,提出假设:
反应的特点,提出假设:假设1:反应后固体中只有
 未氧化;
未氧化;假设2:反应后固体中只有
 完全被氧化;
完全被氧化;假设3:反应后固体中同时含有上述两种物质,证明
 部分被氧化。
部分被氧化。(3)实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:

①试剂a可以选用
②若
 完全被氧化,写出反应的化学方程式
完全被氧化,写出反应的化学方程式③若
 未被氧化,实验测得装置C中
未被氧化,实验测得装置C中 质量增加了
质量增加了 g:装置E中收集气体为VL(标准状况下),写出反应的化学方程式:
g:装置E中收集气体为VL(标准状况下),写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
4 .  是中学化学常用的强氧化剂,除了能与
是中学化学常用的强氧化剂,除了能与 、
、 反应外,还可与其他还原剂如
反应外,还可与其他还原剂如 、C发生反应,某化学课外兴趣小组为探究
、C发生反应,某化学课外兴趣小组为探究 与
与 的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是
的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是

 是中学化学常用的强氧化剂,除了能与
是中学化学常用的强氧化剂,除了能与 、
、 反应外,还可与其他还原剂如
反应外,还可与其他还原剂如 、C发生反应,某化学课外兴趣小组为探究
、C发生反应,某化学课外兴趣小组为探究 与
与 的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是
的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是
| A.实验前应该先检查装置气密性 |
B.U型管中碱石灰的作用是装置中除去 中的 中的 和水蒸气 和水蒸气 |
C.实验过程中,应该先打开b处的弹簧夹,在干燥管上倒插一支小试管收集 ,检验 ,检验 的纯度 的纯度 |
| D.实验结束后,应该先关闭b处的弹簧夹,再撤离酒精灯 |
您最近一年使用:0次
名校
5 . 利用以下装置制备、纯化CO,并探究CO和Na2O2的反应(CO+Na2O2=Na2CO3)。下列说法正确的是
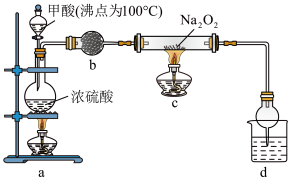

| A.装置b中的试剂可选用无水CaCl2 |
| B.装置d中的试剂可选用NaOH溶液 |
| C.实验开始时,依次点燃a、c处酒精灯 |
| D.加热一段时间后,硬质玻璃管中粉末由白色变为淡黄色 |
您最近一年使用:0次
2022-11-26更新
|
347次组卷
|
4卷引用:广东省广州市2022-2023学年高三上学期11月调研测试化学试题
名校
解题方法
6 . 下列有关物质的性质与用途具有对应关系的是
A. 是两性氧化物,可用作耐高温材料 是两性氧化物,可用作耐高温材料 |
B. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 |
| C.明矾易溶于水,可用作净水剂 |
D. 有强氧化性,可用于漂白 有强氧化性,可用于漂白 |
您最近一年使用:0次
解题方法
7 . 下列“类比”结果正确的是
| A.苯不能使酸性KMnO4溶液褪色,甲苯也不能使酸性KMnO4溶液褪色 |
| B.NH3的分子构型为三角锥形,PCl3的分子构型也为三角锥形 |
| C.Ca(HCO3)2的溶解度比CaCO3的大,NaHCO3的溶解度也比Na2CO3的大 |
| D.Na2O2与CO2反应生成Na2CO3与O2,Na2O2与SO2反应生成Na2SO3与O2 |
您最近一年使用:0次
2022-11-09更新
|
181次组卷
|
2卷引用:广东省惠州市2022-2023学年高三上学期第二次调研考试 化学试题
解题方法
8 . 化合物W的结构如图所示,其中X、Y、Z、M、N是原子序数依次增大的短周期主族元素,Y与N同主族。下列说法错误的是
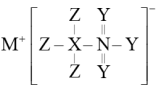
A. 是直线形分子 是直线形分子 |
B.简单离子半径: |
| C.Y分别与X、M和N都能形成两种常见化合物 |
| D.Y和M按照原子个数比为1:1形成的化合物具有强氧化性 |
您最近一年使用:0次
解题方法
9 . 亚硝酸钠(NaNO2)外观酷似食盐且有成味,是一种常用防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
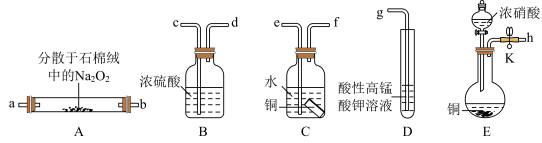
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为 ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片仪器名称是_______ ,其中发生反应的化学方程式_______ ,为检查E装置气密性的方法是_______ 。
(2)上述实验装置中,依次连接的合理顺序为h→_______ →bcdg。
(3)装置D中酸性KMnO4溶液的作用是_______ (用离子方程式表示)。
(4)装置C中水的作用是_______ 。
(5)根据题中信息,设计实验方案,用简单的方法区别亚硝酸钠和氯化钠两种固体_______ (写出操作、现象、结论)。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为
 ;
;③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片仪器名称是
(2)上述实验装置中,依次连接的合理顺序为h→
(3)装置D中酸性KMnO4溶液的作用是
(4)装置C中水的作用是
(5)根据题中信息,设计实验方案,用简单的方法区别亚硝酸钠和氯化钠两种固体
您最近一年使用:0次
名校
解题方法
10 . 向盛有少量Na2O2的密闭容器(体积不变)中通入SO2,测定容器中O2的含量随时间变化曲线如图
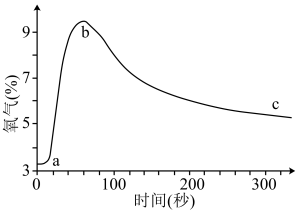
则下列说法错误的是

则下列说法错误的是
| A.ab段O2含量增加的原因:2Na2O2+2SO2=2Na2SO3+O2 |
| B.bc段O2含量缓慢降低的可能原因:反应生成O2的速率小于消耗O2的速率 |
| C.c点O2含量高于a点,则此时反应产物中含有Na2SO3 |
| D.取c点少量固体,加入BaCl2溶液有白色固体生成,证实有Na2SO4生成 |
您最近一年使用:0次
2022-10-17更新
|
187次组卷
|
3卷引用:安徽省示范高中培优联盟 2022-2023学年高二上学期联赛化学试题



