2018高三·全国·专题练习
名校
1 . 某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中正确的是


| A.甲装置:可用来除去CO气体中的CO2气体 |
| B.乙装置:可用来验证NaHCO3和Na2CO3的热稳定性 |
| C.丙装置:可用来实验室制备乙酸乙酯 |
| D.丁装置:可用来比较HCl、H2CO3和H2SiO3的酸性强弱 |
您最近一年使用:0次
2018-02-09更新
|
596次组卷
|
4卷引用:二轮复习 专题14 化学实验综合 押题专练
解题方法
2 . X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
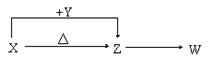
请回答:
⑴W的化学式是____________________ 。
⑵X与Y在溶液中反应的离子方程式是________________________ 。
⑶①将4.48 L(已折算为标准状况)W通入100 mL 3 mol/L的Y的水溶液后,溶液中的溶质是_________ 。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为____________ g。
⑷选用X所含有的四种元素中的两种或三种组成的化合物,并利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体。
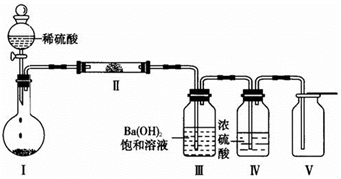
①装置Ⅰ中反应的化学方程式是___________________________________ ,
装置Ⅱ中物质的化学式是_____________ 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是_______________ ,所需仪器装置是________________ (从上图选择必要装置,填写编号)。

请回答:
⑴W的化学式是
⑵X与Y在溶液中反应的离子方程式是
⑶①将4.48 L(已折算为标准状况)W通入100 mL 3 mol/L的Y的水溶液后,溶液中的溶质是
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
⑷选用X所含有的四种元素中的两种或三种组成的化合物,并利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色助燃性气体。

①装置Ⅰ中反应的化学方程式是
装置Ⅱ中物质的化学式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是
您最近一年使用:0次
3 . 由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:

(1)实验室中在右图所示装置中进行碳化反应:
① 碳化反应的主要反应离子方程式为__________ 。
② 碳化时温度需控制在 30℃,可采取的措施是_________ 。 温度不宜过高的原因是________ 。
(2)用 CO2调 pH 为 8~9,其目的是__________ 。
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:
90℃以下,随温度升高,碳酸锂产率升高的原因可能是__________ 。
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中___________ 。

(1)实验室中在右图所示装置中进行碳化反应:

① 碳化反应的主要反应离子方程式为
② 碳化时温度需控制在 30℃,可采取的措施是
(2)用 CO2调 pH 为 8~9,其目的是
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:

90℃以下,随温度升高,碳酸锂产率升高的原因可能是
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中
您最近一年使用:0次
解题方法
4 . 侯氏制碱法:Ⅰ、原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________________ 。
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

回答下列有关问题:
①乙装置中的试剂是________________ ;
②丁装置中稀硫酸的作用是________________ ;
③实验结束后,分离出NaHCO3晶体的操作是________ (填分离操作的名称)。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________ 管通入_________ 气体,再从________ 管中通入________ 气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是________________________ 。
(3)请再写出一种实验室制取少量碳酸氢钠的方法_____________________________ 。
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

回答下列有关问题:
①乙装置中的试剂是
②丁装置中稀硫酸的作用是
③实验结束后,分离出NaHCO3晶体的操作是
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从
②有同学建议在戊装置的b导管下端连接己装置,理由是
(3)请再写出一种实验室制取少量碳酸氢钠的方法
您最近一年使用:0次
5 . 下列实验装置能达到相应实验目的是
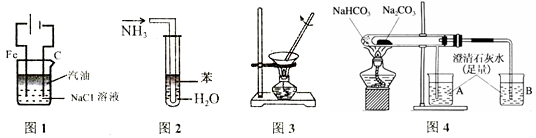

| A.用图1装置制取Fe(OH)2沉淀 |
| B.用图2装置吸收NH3,并防止倒吸 |
| C.用图3装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
| D.用图4装置比较Na2C03与NaHC03的稳定性 |
您最近一年使用:0次
2016-12-09更新
|
151次组卷
|
3卷引用:2016届四川省自贡市高三上第一次诊断考试理综化学试卷
6 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是__________ (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
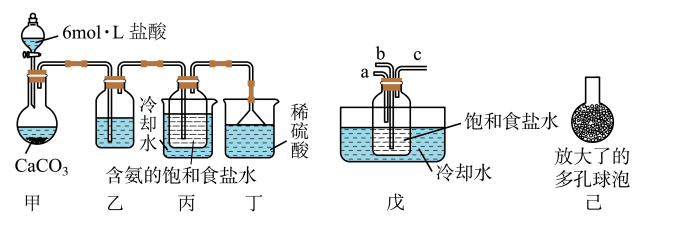
试回答下列有关问题:
①乙装置中的试剂是_____________ 。
②丁装置的作用是____________________ 。
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从a管通入___________ 气体(填气体分子式),再从b管通入__________ 气体(填气体分子式)。
②有同学建议在戊装置的b管下端连接己装置,理由是__________________________ 。
(3)探究小苏打样品(含少量NaCl)中碳酸氢钠的含量:
称取1.840 g小苏打样品(含少量NaCl),配置成250 mL溶液,取出25.00 mL用0.1000mol·L-1盐酸滴定,消耗盐酸21.50 mL。
①实验中所需要的定量仪器除滴定管外,还有______________________________ 。
②样品中NaHCO3质量分数为__________________________ 。
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_____________ 。(选填“偏高”、“偏低”或“不受影响”)
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
①乙装置中的试剂是
②丁装置的作用是
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从a管通入
②有同学建议在戊装置的b管下端连接己装置,理由是
(3)探究小苏打样品(含少量NaCl)中碳酸氢钠的含量:
称取1.840 g小苏打样品(含少量NaCl),配置成250 mL溶液,取出25.00 mL用0.1000mol·L-1盐酸滴定,消耗盐酸21.50 mL。
①实验中所需要的定量仪器除滴定管外,还有
②样品中NaHCO3质量分数为
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次
11-12高一上·广西南宁·阶段练习
7 . Na2CO3是很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(Ⅰ)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(Ⅱ)小心煮沸溶液1~2分钟;(Ⅲ)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。请回答下列问题:
(1)在(Ⅰ)中,刚通入CO2时发生的反应是______ ;而后又发生反应______ 。(请写出化学方程式)
(Ⅱ)中煮沸溶液的目的是______ 。
(Ⅲ)中混合另一半NaOH溶液后发生的反应是______ (请写出离子方程式)
评价该同学能否制得较纯净的Na2CO3?______ 。(填“能”或“不能”)
(2)按该同学的设计,第(Ⅰ)步实验装置如下:
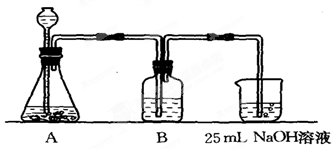
①装置A使用的试剂是______ (固体)和______ 溶液;
②装置B使用的试剂最好是______ (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是______ ;如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有______ 。
(Ⅰ)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(Ⅱ)小心煮沸溶液1~2分钟;(Ⅲ)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。请回答下列问题:
(1)在(Ⅰ)中,刚通入CO2时发生的反应是
(Ⅱ)中煮沸溶液的目的是
(Ⅲ)中混合另一半NaOH溶液后发生的反应是
评价该同学能否制得较纯净的Na2CO3?
(2)按该同学的设计,第(Ⅰ)步实验装置如下:

①装置A使用的试剂是
②装置B使用的试剂最好是
您最近一年使用:0次
2014高三·全国·专题练习
名校
8 . X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
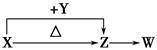
请回答:
(1)W的电子式是_______________________________________________ 。
(2)X与Y在溶液中反应的离子方程式是____________________________ 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
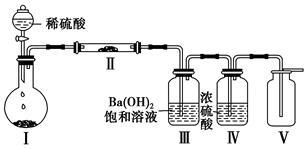
①装置Ⅰ中反应的化学方程式是_______________________________ ,
装置Ⅱ中物质的化学式是_______________________________ 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是_____________ ,所需仪器装置是_____________________ 。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是_______________________________ 。
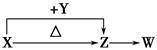
请回答:
(1)W的电子式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。

①装置Ⅰ中反应的化学方程式是
装置Ⅱ中物质的化学式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
您最近一年使用:0次
2016-12-08更新
|
1232次组卷
|
4卷引用:2014年高考化学鲁科版3.1碳的多样性练习卷
(已下线)2014年高考化学鲁科版3.1碳的多样性练习卷河北省鸡泽县第一中学2016-2017学年高二下学期期末考试化学试题浙江省宁波三中2019-2020学年高三10月月考化学试题(已下线)第13单元 化学实验基本操作(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
名校
解题方法
9 . 大苏打(Na2S2O3,名称是硫代硫酸钠)、苏打、小苏打被称为“苏氏三兄弟”。某小组设计实验探究它们的性质。
(1)大苏打属于_______(填字母)。
(2)探究Na2CO3、NaHCO3溶液与Al2(SO4)3溶液反应。
已知:Na2CO3溶液、NaHCO3溶液的浓度相同。用相同浓度的Al2(SO4)3溶液进行实验,实验结果如下:
已知白色沉淀是Al(OH)3,产生的气体属于酸性氧化物,它是_______ (填化学式)。根据实验结果,常用的泡沫灭火器选用试剂是Al2(SO4)3和_______ (填“NaHCO3”或“Na2CO3”)。
(3)设计下列实验装置探究NaHCO3的热稳定性以及Na2O2供氧原理。

①实验中,观察到B装置白色粉末变为蓝色,则说明A中碳酸氢钠分解生成了_______ (填化学式)。
②实验中观察到C中淡黄色粉末逐渐变为白色,用带火星木条靠近a管口,木条燃烧更旺,说明C中生成了_______ (填化学式)。写出C中可能发生反应的化学方程式:_______ 、_______ 。在上述反应中,氧化剂、还原剂质量之比为_______ 。
③实验完毕后,经检验A中试管里残留固体是Na2CO3,写出A中发生反应的化学方程式:_______ ,反应类型是_______ (填基本反应类型)。
(1)大苏打属于_______(填字母)。
| A.碱 | B.盐 | C.氧化物 | D.酸 |
已知:Na2CO3溶液、NaHCO3溶液的浓度相同。用相同浓度的Al2(SO4)3溶液进行实验,实验结果如下:
| 实验 | 操作 | 现象 |
| 甲 | 在5 mL Al2(SO4)3溶液中加入5 mL Na2CO3溶液 | 缓慢产生少量气泡,缓慢产生白色胶状难溶物 |
| 乙 | 在5 mL Al2(SO4)3溶液中加入5 mLNaHCO3溶液 | 立即产生大量气泡,迅速产生白色胶状难溶物 |
(3)设计下列实验装置探究NaHCO3的热稳定性以及Na2O2供氧原理。

①实验中,观察到B装置白色粉末变为蓝色,则说明A中碳酸氢钠分解生成了
②实验中观察到C中淡黄色粉末逐渐变为白色,用带火星木条靠近a管口,木条燃烧更旺,说明C中生成了
③实验完毕后,经检验A中试管里残留固体是Na2CO3,写出A中发生反应的化学方程式:
您最近一年使用:0次
2022-11-14更新
|
105次组卷
|
2卷引用:江西省抚州市七校2022-2023学年高一上学期期中联考化学试题



