解题方法
1 . 下列关于各实验装置的描述中,不恰当的是
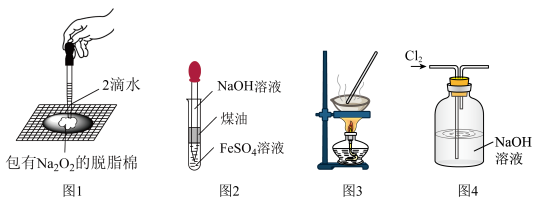
| A.图1的实验可以证明过氧化钠与水反应放热 |
B.图2中的溶液要提前驱除溶解的氧气,以制备 |
| C.图3的装置可以用于去除碳酸钠中的碳酸氢钠 |
| D.图4的装置可能发生倒吸,需要改进 |
您最近一年使用:0次
2 . 刘丽同学在实验室看到一瓶没有标签的白色粉末,经询问老师得知可能是食盐、碳酸钠或碳酸氢钠。于是她和自己小组的同学们一起对白色粉末的成分进探究。
【作出猜想】
(1)猜想1:可能是食盐 猜想2:可能是_____ 猜想3:可能是_____
【查阅资料】碳酸氢钠的性质:①水溶液呈碱性;②受热易分解;③能和氢氧化钠溶液发生化学反应:NaHCO3+NaOH=Na2CO3+H2O。
【实验探究】
(2)方案如下:
【反思评价】
(3)张伟同学认为通过上述实验还不能确定这种白色粉末就是碳酸钠,他的理由是_____ 。
【继续探究】
(4)小组同学们于是另取了少量白色粉末于试管中,管口塞上带导管的橡胶塞,再将导管通入澄清石灰水中,给试管加热,观察到澄清石灰水未变浑浊,得出该白色粉末是_____ 。
【交流总结】
(5)通过本组同学的探究,作为组长的刘丽同学根据已有的知识及实验情况,总结出了鉴别碳酸钠和碳酸氢钠的如下方法:
①用无色酚酞试液进行鉴别;②用加热的方法进行鉴别;③加入稀盐酸进行鉴别;④加入澄清石灰水进行鉴别。你认为其中可行的是_____ (填序号)。
【拓展延伸】
(6)碳酸氢钠俗称_____ ,在日常生活中用于生产食品,主要起发泡作用,通过上述研究性学习过程,你认为碳酸氢钠除用于食品工业外,在日常生活及实验室中还有哪些应用,试举一例:_____ 。
【作出猜想】
(1)猜想1:可能是食盐 猜想2:可能是
【查阅资料】碳酸氢钠的性质:①水溶液呈碱性;②受热易分解;③能和氢氧化钠溶液发生化学反应:NaHCO3+NaOH=Na2CO3+H2O。
【实验探究】
(2)方案如下:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量白色粉末于试管中,加入足量水溶解,滴加1~2滴无色酚酞试液 | 溶液变红色 | 该白色粉末不是 |
| 取少量该溶液,向其中滴加稀盐酸 | ||
| 再取少量该溶液,向其中滴加澄清石灰水 | 产生白色沉淀 | 该白色粉末是碳酸钠 |
【反思评价】
(3)张伟同学认为通过上述实验还不能确定这种白色粉末就是碳酸钠,他的理由是
【继续探究】
(4)小组同学们于是另取了少量白色粉末于试管中,管口塞上带导管的橡胶塞,再将导管通入澄清石灰水中,给试管加热,观察到澄清石灰水未变浑浊,得出该白色粉末是
【交流总结】
(5)通过本组同学的探究,作为组长的刘丽同学根据已有的知识及实验情况,总结出了鉴别碳酸钠和碳酸氢钠的如下方法:
①用无色酚酞试液进行鉴别;②用加热的方法进行鉴别;③加入稀盐酸进行鉴别;④加入澄清石灰水进行鉴别。你认为其中可行的是
【拓展延伸】
(6)碳酸氢钠俗称
您最近一年使用:0次
名校
3 . 按要求回答下列问题:
(1)现有以下物质:①Cl2②CO2③Na2O④NaHSO4⑤漂白粉⑥NaOH溶液⑦Ba(OH)2,其中属于酸性氧化物的有
(2)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
(3)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | A | B | C | D | E | F | G |
原子半径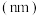 | 0.186 | 0.160 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
①七种元素的最高价氧化物的水化物中,酸性最强的是
②B、E、G的离子半径由大到小的顺序是
③元素G的最简单氢化物的结构式
(4)200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2充分反应后,得到Na2CO3和NaHCO3的混合溶液,向上述所得溶液中,逐滴加入2mol/L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示(不考虑体积变化):
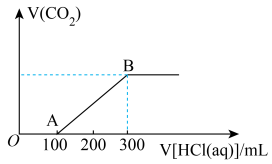
B点时,反应所得溶液中溶质的物质的量浓度是
(5)向浑浊的水中加入明矾(KAl(SO4)2·12H2O)后,水可得到净化。写出硫酸铝钾在水中的电离方程式:
您最近一年使用:0次
4 . 某种天然碱的化学式为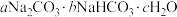 ,某实验小组欲测定该天然碱中
,某实验小组欲测定该天然碱中 与
与 的比例,进行了如下实验。回答下列问题
的比例,进行了如下实验。回答下列问题
(1)配制一定物质的量浓度的稀盐酸溶液。
①若要配制250mL 稀盐酸,需量取
稀盐酸,需量取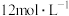 的浓盐酸
的浓盐酸__________  (计算结果保留1位小数)。
(计算结果保留1位小数)。
②配制溶液过程中,下列关于容量瓶的操作,正确的是__________ (填字母,下同)。
A.检验容量瓶是否漏水 B.定容
B.定容
C.转移 D.摇匀
D.摇匀
③下列情况会使所配溶液浓度偏低的是__________ 。
A.容量瓶清洗后,未经过干燥处理
B.转移时,没有洗涤烧杯和玻璃棒
C.溶液未经冷却直接倒入容量瓶中
D.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)取一定质量该天然碱溶于水,逐滴加入稀盐酸,溶液中 的物质的量与加入
的物质的量与加入 的物质的量关系如图所示。
的物质的量关系如图所示。
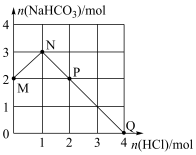
①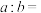
__________ ;
②P点处溶液中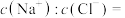
__________ ;
③若Q点时溶液体积为5L,则溶液中 的浓度为
的浓度为__________ ;
④“M→N”过程中发生反应的离子方程式是____________________ 。
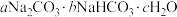 ,某实验小组欲测定该天然碱中
,某实验小组欲测定该天然碱中 与
与 的比例,进行了如下实验。回答下列问题
的比例,进行了如下实验。回答下列问题(1)配制一定物质的量浓度的稀盐酸溶液。
①若要配制250mL
 稀盐酸,需量取
稀盐酸,需量取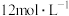 的浓盐酸
的浓盐酸 (计算结果保留1位小数)。
(计算结果保留1位小数)。②配制溶液过程中,下列关于容量瓶的操作,正确的是
A.检验容量瓶是否漏水
 B.定容
B.定容
C.转移
 D.摇匀
D.摇匀
③下列情况会使所配溶液浓度偏低的是
A.容量瓶清洗后,未经过干燥处理
B.转移时,没有洗涤烧杯和玻璃棒
C.溶液未经冷却直接倒入容量瓶中
D.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)取一定质量该天然碱溶于水,逐滴加入稀盐酸,溶液中
 的物质的量与加入
的物质的量与加入 的物质的量关系如图所示。
的物质的量关系如图所示。
①
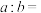
②P点处溶液中
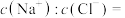
③若Q点时溶液体积为5L,则溶液中
 的浓度为
的浓度为④“M→N”过程中发生反应的离子方程式是
您最近一年使用:0次
解题方法
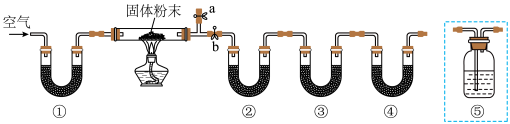
5 . 某固体粉末中可能有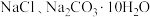 和
和 中的一种或几种组分,某同学取mg固体粉末,设计如下实验,通过测量反应前后装置②和③质量的变化,确定该粉末的组分。下列说法错误的是
中的一种或几种组分,某同学取mg固体粉末,设计如下实验,通过测量反应前后装置②和③质量的变化,确定该粉末的组分。下列说法错误的是
 和
和 中的一种或几种组分,某同学取mg固体粉末,设计如下实验,通过测量反应前后装置②和③质量的变化,确定该粉末的组分。下列说法错误的是
中的一种或几种组分,某同学取mg固体粉末,设计如下实验,通过测量反应前后装置②和③质量的变化,确定该粉末的组分。下列说法错误的是
A.装置①、②、③、④中依次盛装碱石灰、无水 、碱石灰、碱石灰 、碱石灰、碱石灰 |
| B.可以将装置④替换为盛有浓硫酸的装置⑤ |
C.实验结束后,装置②、③增加的质量之比大于9∶22,说明粉末中含有 和 和 |
D.若将装置①替换为盛有NaOH溶液的装置⑤,则可能误判存在 |
您最近一年使用:0次
名校
6 . 化学与生活密切相关,下列说法不正确的是
| A.胆矾可作为湿法冶铜的原料 |
| B.加入食醋可提高“84”消毒液的消毒效率 |
C.大飞机 用到了铝锂合金,因该合金密度小、强度大、耐腐蚀 用到了铝锂合金,因该合金密度小、强度大、耐腐蚀 |
| D.苏打加热易分解,常用于制作馒头和面包的膨松剂 |
您最近一年使用:0次
解题方法
7 . 永利川西化工厂是侯德榜主导的中国早期的制碱厂,其工艺流程图如图,请结合相关知识回答下列问题:

(1)上述化学式表示的五种物质中,属于电解质的有 NaHCO3和___________ 。(填化学式)
(2)写出碳酸氢钠在水中电离的电离方程式:___________ ,“煅烧”时发生反应的化学方程式为___________ 。
(3)某实验小组欲用稀盐酸测定所制得的纯碱中碳酸钠(杂质为NaCl)的含量,预计实验中需要消耗480mL 1mol·L-1稀盐酸。
①实验室用36.5%的浓盐酸(密度为12g·cm-3)配制上述所需稀盐酸。
a.上述浓盐酸的物质的量浓度为___________ mol·L-1.实验中,需要量取的浓盐酸的体积为___________ (保留一位小数)mL。
b.配制稀盐酸需要用到的仪器有量筒、烧杯、玻璃棒,还缺少的玻璃仪器有___________ (填仪器名称)。
②若实验过程中遇到下列情况,导致所配溶液物质的量浓度偏低的是___________ (填标号)。
A.定容时俯视刻度线读数
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
③产品分析:把5.8g Na2CO3产品溶于足量稀硫酸,充分反应后,将产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重1.4g,产品纯度为___________ (保留到小数点后1位)%。

(1)上述化学式表示的五种物质中,属于电解质的有 NaHCO3和
(2)写出碳酸氢钠在水中电离的电离方程式:
(3)某实验小组欲用稀盐酸测定所制得的纯碱中碳酸钠(杂质为NaCl)的含量,预计实验中需要消耗480mL 1mol·L-1稀盐酸。
①实验室用36.5%的浓盐酸(密度为12g·cm-3)配制上述所需稀盐酸。
a.上述浓盐酸的物质的量浓度为
b.配制稀盐酸需要用到的仪器有量筒、烧杯、玻璃棒,还缺少的玻璃仪器有
②若实验过程中遇到下列情况,导致所配溶液物质的量浓度偏低的是
A.定容时俯视刻度线读数
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
③产品分析:把5.8g Na2CO3产品溶于足量稀硫酸,充分反应后,将产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重1.4g,产品纯度为
您最近一年使用:0次
名校
8 . 下列选项描述与对应图像相符的是
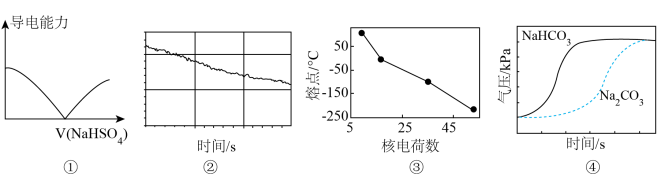

| A.图①为向Ba(OH)2溶液中滴加等浓度的NaHSO4溶液时,溶液导电能力的变化 |
| B.图②为新制饱和氯水在受到阳光直射时,溶液中c(H+)的变化 |
| C.图③为卤族元素单质的熔点随核电荷数递增的变化 |
| D.图④为向盛有Na2CO3和NaHCO3溶液的密闭容器中滴入等浓度盐酸时气压的变化 |
您最近一年使用:0次
2024-03-20更新
|
59次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高一下学期开学化学试题
名校
解题方法
9 . 钠是由汉弗莱·戴维发现的,它是一种很好的热和电导体,也是人体中的一种重要元素,具有调节血压的功能,下列关于含钠元素物质的说法错误的是
| A.实验后剩余少量的钠可放回原试剂瓶中 |
| B.钠着火后可用水浇灭 |
| C.氧化钠和过氧化钠两种物质的颜色不同 |
| D.治疗胃酸过多可以用NaHCO3 |
您最近一年使用:0次
名校
解题方法
10 . 已知物质 有如图转化关系(部分反应条件及产物已省略):
有如图转化关系(部分反应条件及产物已省略):
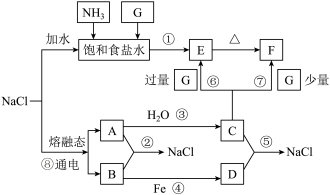
(1)上述流程中涉及到的下列物质①氨水② ③
③ ④熔融
④熔融 ⑤
⑤ ⑥
⑥ 其中属于强电解质的是
其中属于强电解质的是______ (填标号)。
(2)反应①产物除E外,另一种是______ (填化学式)。
(3)写出 受热反应的化学方程式:
受热反应的化学方程式:______ 。
(4)写出饱和 溶液中通入过量
溶液中通入过量 发生反应的离子方程式:
发生反应的离子方程式:______ 。
(5)物质A在空气中燃烧产物M的颜色为______ ,M中阴阳离子的物质的量的比值为______ 。
 有如图转化关系(部分反应条件及产物已省略):
有如图转化关系(部分反应条件及产物已省略):
(1)上述流程中涉及到的下列物质①氨水②
 ③
③ ④熔融
④熔融 ⑤
⑤ ⑥
⑥ 其中属于强电解质的是
其中属于强电解质的是(2)反应①产物除E外,另一种是
(3)写出
 受热反应的化学方程式:
受热反应的化学方程式:(4)写出饱和
 溶液中通入过量
溶液中通入过量 发生反应的离子方程式:
发生反应的离子方程式:(5)物质A在空气中燃烧产物M的颜色为
您最近一年使用:0次



