1 . 钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)常温下,金属钠露置在空气中会发生变化,实验室通常把钠保存在___________ 中。
(2)除去碳酸钠固体中碳酸氢钠的方法是___________ 。
(3)实验室在保存含有Fe2+的溶液时,为了防止Fe2+变质,经常向其中加入________ (填“铁粉”或“铜粉”)。
(4)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式:________ 。
(1)常温下,金属钠露置在空气中会发生变化,实验室通常把钠保存在
(2)除去碳酸钠固体中碳酸氢钠的方法是
(3)实验室在保存含有Fe2+的溶液时,为了防止Fe2+变质,经常向其中加入
(4)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式:
您最近一年使用:0次
名校
2 . NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
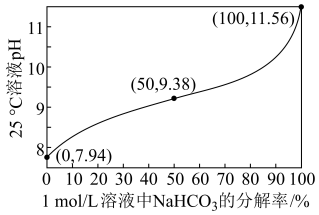
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
您最近一年使用:0次
2024-01-17更新
|
115次组卷
|
2卷引用:四川省绵阳市东辰学校2022-2023学年高一上学期期末模拟化学试卷
3 . 生活处处有化学,制作馒头、面包等所用的发酵粉,主要成分是由 、
、 和固体有机酸混合而成的。
和固体有机酸混合而成的。
(1)将 和
和 分别加热,能产生
分别加热,能产生 的物质是
的物质是___________ (填化学式),该反应的化学方程式为___________ 。
(2)向盛有 溶液的试管中滴加澄清石灰水,可观察到(填实验现象)
溶液的试管中滴加澄清石灰水,可观察到(填实验现象)___________ ,发生的离子反应方程式为___________ 。 可用于治疗胃酸过多,反应的离子方程式为
可用于治疗胃酸过多,反应的离子方程式为___________ 。
(3)下列实验方案中,能测定出 和
和 的混合物中
的混合物中 质量分数的是___________。
质量分数的是___________。
 、
、 和固体有机酸混合而成的。
和固体有机酸混合而成的。(1)将
 和
和 分别加热,能产生
分别加热,能产生 的物质是
的物质是(2)向盛有
 溶液的试管中滴加澄清石灰水,可观察到(填实验现象)
溶液的试管中滴加澄清石灰水,可观察到(填实验现象) 可用于治疗胃酸过多,反应的离子方程式为
可用于治疗胃酸过多,反应的离子方程式为(3)下列实验方案中,能测定出
 和
和 的混合物中
的混合物中 质量分数的是___________。
质量分数的是___________。| A.取ag混合物充分加热至恒重,剩余固体质量为bg |
B.取ag混合物与足量 溶液充分反应,加热、蒸干、灼烧,得到bg固体 溶液充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
名校
解题方法
4 . 碳酸钠和碳酸氢钠是厨房里常见的两种物质,某实验小组的同学为探究碳酸钠和碳酸氢钠的性质,进行了如下实验。请按照要求回答下列问题:
(1)取少量 粉末配成溶液,向其中滴加几滴酚酞试液,现象是
粉末配成溶液,向其中滴加几滴酚酞试液,现象是_______ 。
(2)利用如图所示装置进行 的受热分解实验。
的受热分解实验。

①安装好仪器后首先应该进行的操作是_______ ;
②试管a中盛放的试剂是_______ ;
③ 受热分解的化学方程式是
受热分解的化学方程式是_______ ;
(3)请利用下列所给试剂,设计一种能快速简便的鉴别碳酸钠和碳酸氢钠的最佳方法。
实验试剂如下:
主要试剂:碳酸钠固体和碳酸氢钠固体。
可选试剂:蒸馏水、氢氧化钙溶液、氯化钙溶液。
简述实验的方案:_______ ,写出所涉及的离子方程式_______ 。
(4)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为_______ g、_______ g。
(1)取少量
 粉末配成溶液,向其中滴加几滴酚酞试液,现象是
粉末配成溶液,向其中滴加几滴酚酞试液,现象是(2)利用如图所示装置进行
 的受热分解实验。
的受热分解实验。
①安装好仪器后首先应该进行的操作是
②试管a中盛放的试剂是
③
 受热分解的化学方程式是
受热分解的化学方程式是(3)请利用下列所给试剂,设计一种能快速简便的鉴别碳酸钠和碳酸氢钠的最佳方法。
实验试剂如下:
主要试剂:碳酸钠固体和碳酸氢钠固体。
可选试剂:蒸馏水、氢氧化钙溶液、氯化钙溶液。
简述实验的方案:
(4)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为
您最近一年使用:0次
名校
解题方法
5 . 填空。
(1)钠元素在自然界都以化合物的形式存在。过氧化钠中氧元素的化合价为___________ 价,焰色试验为___________ 色(填颜色)。过氧化钠用于呼吸面具的反应方程式为①___________ ,②___________ 。上述任一个反应中,若有1molO2生成,转移的电子数目为___________ 个。(用含NA的表达式作答)
(2)利用下图比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为___________ 。

(3)已知NH3和Cl2在常温下可以快速发生反应:8NH3+3Cl2=N2+6NH4Cl;化工厂利用该原理,可用浓氨水来检验输送氯气的管道是否漏气,请按要求回答下列问题:
①9.03×1023个NH3分子其物质的量为___________ mol,含有___________ mol电子。
②用“双线桥”标出该反应8NH3+3Cl2═N2+6NH4Cl电子转移的方向和数目___________ ,当反应有14gN2生成时,参加反应的NH3物质的量为___________ mol。
(1)钠元素在自然界都以化合物的形式存在。过氧化钠中氧元素的化合价为
(2)利用下图比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为

(3)已知NH3和Cl2在常温下可以快速发生反应:8NH3+3Cl2=N2+6NH4Cl;化工厂利用该原理,可用浓氨水来检验输送氯气的管道是否漏气,请按要求回答下列问题:
①9.03×1023个NH3分子其物质的量为
②用“双线桥”标出该反应8NH3+3Cl2═N2+6NH4Cl电子转移的方向和数目
您最近一年使用:0次
6 . NaCl是一种化工原料,可以制备一系列物质,如图所示。

(1)下列说法不正确的是___________(填字母)。
(2)Cl2与Ca(OH)2反应的化学方程式为___________ 。
(3)84消毒液(含次氯酸钠)不能与洁厕剂(含盐酸)混合使用,否则可能产生使人中毒的气体,请解释其原因___________ (用化学反应方程式表示)。
(4)纯净的氢气在氯气中燃烧的现象是___________ 。
(5)实验室常用浓盐酸和MnO2加热制备氯气,请写出该反应的离子方程式___________ 。

(1)下列说法不正确的是___________(填字母)。
| A.Na2CO3的热稳定性比NaHCO3强 |
| B.侯氏制碱法可以制得Na2CO3 |
| C.图示转化反应都是氧化还原反应 |
| D.焰色试验中需用硫酸洗净铁丝,并灼烧至与原来的火焰颜色相同为止 |
(2)Cl2与Ca(OH)2反应的化学方程式为
(3)84消毒液(含次氯酸钠)不能与洁厕剂(含盐酸)混合使用,否则可能产生使人中毒的气体,请解释其原因
(4)纯净的氢气在氯气中燃烧的现象是
(5)实验室常用浓盐酸和MnO2加热制备氯气,请写出该反应的离子方程式
您最近一年使用:0次
解题方法
7 . 硫酸钠(①Na2SO4)是一种无机化合物,不溶于②乙醇,溶于③水、甘油,用途非常广泛。硫酸钠的制备方法很多,如可由④NaOH或⑤NaHCO3与⑥H2SO4反应制得,也可由⑦Na2CO3溶液与⑧CuSO4溶液反应制得,除了生成Na2SO4外,还生成⑨Cu(OH)2CO3、⑩CO2,请回答下列问题:
(1)上述标有序号的物质中是电解质的是_____ (填序号)。
(2)①在水中的电离方程式为_____ ,检验某溶液中是否含有①中阴离子的实验操作为_____ 。
(3)④与⑤的溶液反应的离子方程式为_____ ;向⑦中滴加少量⑥的稀溶液,发生反应的离子方程式为_____ 。
(4)通过实验制得粒子直径为70nm左右的⑨,并将其均与分散在②中(已知碱式碳酸制不溶于乙醇),得到的分散系为_____ ,可用_____ (写实验方法)检验。
(1)上述标有序号的物质中是电解质的是
(2)①在水中的电离方程式为
(3)④与⑤的溶液反应的离子方程式为
(4)通过实验制得粒子直径为70nm左右的⑨,并将其均与分散在②中(已知碱式碳酸制不溶于乙醇),得到的分散系为
您最近一年使用:0次
2023-10-01更新
|
109次组卷
|
2卷引用:山东省2022-2023学年高一上学期期中联合调考化学试题
解题方法
8 . 按要求写出下列方程式。
有下列七种物质:①盐酸;②Fe;③CH3COOH;④SO2;⑤熔融的Al2(SO4)3;⑥NaHCO3固体;⑦NaOH溶液;
(1)属于非电解质的是___________ ;属于电解质的是___________ ;属于强电解质的是___________ ;所给状态能导电的是___________ 。(以上均填所给物质的序号)
(2)将⑥加入①中发生反应的离子方程式为:___________ 。
(3)将③加入⑦中,发生反应的离子方程式为:___________ 。
(4)过氧化钠可做呼吸面具的供氧剂,有关化学方程式___________ 。除去NaHCO3溶液中的Na2CO3的有关化学方程式为___________ 。
有下列七种物质:①盐酸;②Fe;③CH3COOH;④SO2;⑤熔融的Al2(SO4)3;⑥NaHCO3固体;⑦NaOH溶液;
(1)属于非电解质的是
(2)将⑥加入①中发生反应的离子方程式为:
(3)将③加入⑦中,发生反应的离子方程式为:
(4)过氧化钠可做呼吸面具的供氧剂,有关化学方程式
您最近一年使用:0次
名校
解题方法
9 . 请写出除去下列物质中少量杂质的方法或所加入的试剂。
(1)除去Na2CO3粉末中混有的少量NaHCO3___________ 。
(2)除去NaHCO3溶液中混有的少量Na2CO3___________ 。
(3)除去CO2气体中混有的少量HCl气体___________ 。
(1)除去Na2CO3粉末中混有的少量NaHCO3
(2)除去NaHCO3溶液中混有的少量Na2CO3
(3)除去CO2气体中混有的少量HCl气体
您最近一年使用:0次
解题方法
10 . 碳酸钠和碳酸氢钠是厨房常见物质,某小组为探究碳酸钠和碳酸氢钠的性质,进行如下实验。
(1)取少量Na2CO3粉末配成溶液,向其中滴加几滴酚酞试液,现象是
_____ 。
(2)利用如图所示装置进行NaHCO3的受热分解实验。

①安装好仪器后首先应该进行的操作是_____ ;
②试管a中盛放的试剂是_____ ;
③NaHCO3受热分解的化学方程式是_____ ;
(3)可用来鉴别NaHCO3溶液和Na2CO3溶液的试剂为
_____ 。
①CO2②澄清石灰水③CaCl2溶液④NaHSO4溶液⑤稀盐酸⑥NaOH溶液
(4)写出澄清石灰水与过量NaHCO3溶液反应的离子方程式
_____ ;
(1)取少量Na2CO3粉末配成溶液,向其中滴加几滴酚酞试液,现象是
(2)利用如图所示装置进行NaHCO3的受热分解实验。

①安装好仪器后首先应该进行的操作是
②试管a中盛放的试剂是
③NaHCO3受热分解的化学方程式是
(3)可用来鉴别NaHCO3溶液和Na2CO3溶液的试剂为
①CO2②澄清石灰水③CaCl2溶液④NaHSO4溶液⑤稀盐酸⑥NaOH溶液
(4)写出澄清石灰水与过量NaHCO3溶液反应的离子方程式
您最近一年使用:0次



