1 . 按如图所示装置进行实验,逐滴加入液体x后,下列实验目的能够实现的是
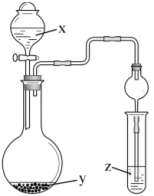

| 选项 | x | y | z | 实验目的 |
| A | 浓氨水 | 生石灰 | AlCl3溶液 | 验证Al(OH)3能溶于碱 |
| B | 稀硫酸 | 小苏打 | 澄清石灰水 | 验证硫酸的酸性强于碳酸 |
| C | 水 | 过氧化钠 | FeCl2溶液 | 验证Cl—具有还原性 |
| D | 70%硫酸 | 亚硫酸钠 | 溴水 | 验证二氧化硫的漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度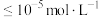 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度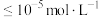 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次
名校
解题方法
3 . 絮凝剂聚合氯化铝{ ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙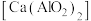 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下: 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。
(1)“碱溶”时,化学反应方程式为___________ 。
(2)若滤液浓度较大,则通入过量 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是___________ 。
(3)“酸化”时的装置如图所示,仪器A的名称为___________ ,若要使产品盐基度为 ,则
,则
___________ ;先将 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是____________ 。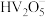 、
、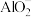 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水,___________ ,向其中滴加一定量的盐酸,得到聚合氯化铝。(实验中须使用的试剂有: 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)
 ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙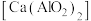 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下: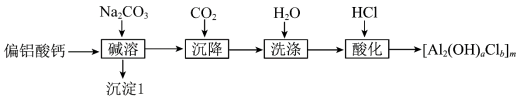
 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。(1)“碱溶”时,化学反应方程式为
(2)若滤液浓度较大,则通入过量
 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是(3)“酸化”时的装置如图所示,仪器A的名称为
 ,则
,则
 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是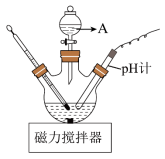
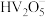 、
、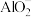 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水, 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)| 化合价 |  |  |
| +4价V | 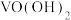 沉淀 沉淀 | 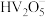 |
| +5价V | 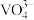 | 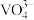 |
| +3价Al |  沉淀 沉淀 | 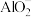 |
您最近一年使用:0次
名校
解题方法
4 . Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
②部分物质的溶解度曲线见下图。
(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是___________ 。___________ 。分两次调节pH的主要原因是___________ 。
(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入___________ 杂质(填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:___________ 。
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:___________ ,干燥,得到CoC2O4·2H2O晶体。(须使用的试剂:NaClO3,NaOH,AgNO3溶液,(NH4)2C2O4,蒸馏水)
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积___________ 。(写出计算过程,结果保留2位有效数字)
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
| 沉淀 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 恰好完全沉淀时pH | 5.2 | 8.8 | 3.2 | 9.4 | 9.8 | 11.1 |

(1)酸浸,向锂云母矿石中加入50%硫酸,加热至90℃,装置如图所示。烧杯中试剂的作用是

(3)沉锂,将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
(5)CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积
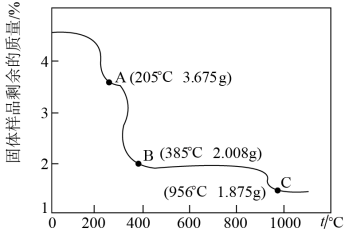
您最近一年使用:0次
5 . 牙膏是由粉状摩擦剂、湿润剂、表面活性剂、粘合剂、香料、甜味剂及其它特殊成分构成的。经查文献获悉,某品牌牙膏中摩擦剂由碳酸钙、氢氧化铝组成,牙膏中其它成分不与酸、碱反应。
I.测定牙膏中摩擦剂碳酸钙的含量:利用下图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数。图中夹持仪器略去。
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是___________ (填字母代号)。
a. 组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水。打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气。
b. 装好药品后,关闭K1和K3、打开K2。打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气。
c. 短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气。
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有
___________ 。
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?___________ 。
(4)实验中准确称取20.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g。则样品中碳酸钙的质量分数为___________ 。
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验。
I.测定牙膏中摩擦剂碳酸钙的含量:利用下图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数。图中夹持仪器略去。
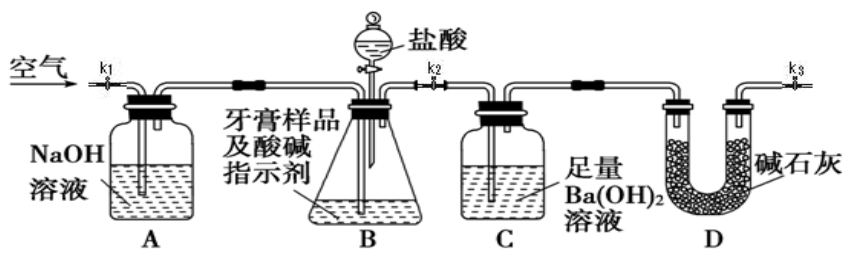
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是
a. 组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水。打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气。
b. 装好药品后,关闭K1和K3、打开K2。打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气。
c. 短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气。
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?
(4)实验中准确称取20.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g。则样品中碳酸钙的质量分数为
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验。
实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中, |
您最近一年使用:0次
6 . 绿色化学是当前化学研究的热点,为了实现经济可持续性发展,充分利用资源,某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3、MgO和SiO2等杂质)制备四氢铝锂(LiAlH4)和冰晶石(Na3AlF6)。四氢铝锂是有机合成的重要还原剂,冰晶石常作工业上冶炼铝的助熔剂。其工艺流程如下:

请回答下列问题:
(1)为了提高酸浸效率,除了升高温度,还可以增大硫酸的浓度,但硫酸浓度增大到一定数值后,浸出率反而降低,原因是_______
(2)滤渣2的主要成分是_______ 。
(3)AlCl3溶于水导电,但熔融时不导电原因是_______ 。
(4)写出滤液2与足量CO2反应的离子方程式:_______ 。
(5)根据流程发生反应2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O制备冰晶石,该反应不能在玻璃容器中进行的原因是_______ (用化学方程式来解释)。
(6)根据方程式2Fe3++Fe=3Fe2+设计电池。
①画出装置图,标出电极材料、名称、电子流向及电解质溶液_______ ;
②写出电极反应式_______ 。

请回答下列问题:
(1)为了提高酸浸效率,除了升高温度,还可以增大硫酸的浓度,但硫酸浓度增大到一定数值后,浸出率反而降低,原因是
(2)滤渣2的主要成分是
(3)AlCl3溶于水导电,但熔融时不导电原因是
(4)写出滤液2与足量CO2反应的离子方程式:
(5)根据流程发生反应2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O制备冰晶石,该反应不能在玻璃容器中进行的原因是
(6)根据方程式2Fe3++Fe=3Fe2+设计电池。
①画出装置图,标出电极材料、名称、电子流向及电解质溶液
②写出电极反应式
您最近一年使用:0次
解题方法
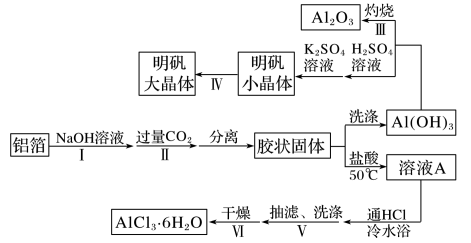
7 . 明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如下:

(1)“碱溶”步骤中发生反应的化学方程式为_______ 。
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为_______ 。
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、_______ 、_______ 。
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是_______ ,圆底烧瓶中发生反应的离子方程式为_______ 。

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,_______ ,过滤,冷水洗涤,干燥,得到明矾晶体(实验中需用到的试剂:K2SO4固体)。

(1)“碱溶”步骤中发生反应的化学方程式为
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,
您最近一年使用:0次
8 . 某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
请回答:
(1)步骤Ⅰ中的化学方程式______________________________________ 。步骤Ⅱ中生成Al(OH)3的离子方程式________________________________________ 。
(2)步骤Ⅲ,下列操作合理的是______________________ 。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________ 。
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
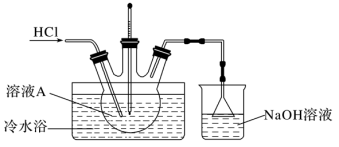
(4)由溶液A制备AlCl3·6H2O的装置如图:________________ 。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是____________________________ ;
洗涤时,合适的洗涤剂是______________________ 。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___________________ 。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| 溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)步骤Ⅰ中的化学方程式
(2)步骤Ⅲ,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如图:
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是
洗涤时,合适的洗涤剂是
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
您最近一年使用:0次
2017-11-06更新
|
4634次组卷
|
6卷引用:浙江省2017年11月普通高校招生选考科目考试化学试题
浙江省2017年11月普通高校招生选考科目考试化学试题2017年11月浙江省普通高校招生选考科目考试化学试题2019届高三化学镁、铝及其化合物一轮复习针对训练题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)吉林省通化县综合高级中学2021-2022学年高三上学期第一次模拟考试化学试题江西省宁冈中学2021-2022学年高三上学期9月份开学考化学试题



